ของแข็ง ของเหลว แก๊ส (ตอนที่ 2) สมบัติของของแข็ง
สมบัติของของแข็ง
ของแข็ง หมายถึง สารที่อนุภาคมีพลังงานจลน์ต่ำ ไม่เคลื่อนที่ไปมาแต่มีการสั่นสะเทือนได้โดยเป็นการสั่นสะเทือนอยู่ ณ ที่เดิม จึงทำให้ของแข็งมีรูปร่างหรือรูปทรงและปริมาตรของคงที่ ไม่เปลี่ยนไปตามรูปร่างของภาชนะที่บรรจุ อนุภาคอยู่ใกล้ชิดกันมากจึงมีที่ว่างน้อยจึงไม่สามารถบีบอัดของแข็งให้มัปริมาตรลดลงได้ มีแรงยึดเหนี่ยวระหว่างอนุภาคมาก เมื่อพิจารณาของแข็งจากรูปผลึก จะจำแนกได้ 2 ชนิด คือ
- ของแข็งที่ไม่มีรูปผลึก (amorphous solids) เช่น แก้ว ยาง พลาสติก ของแข็งประเภทนี้จะมีจุดหลอมเหลวที่ไม่ชัดเจนเนื่องจากแรงดึงดูดระหว่างอนุภาคจะไม่สม่ำเสมอกัน การจัดเรียงอนุภาคไม่มีระเบียบที่แน่นอน จึงไม่เกิดรูปผลึกเฉพาะตัว เช่น ขี้ผึ้ง แก้ว
- ของแข็งที่มีรูปผลึก (crystalline solids) ของแข็งชนิดนี้มีการจัดเรียงของอนุภาคเป็นระเบียบ จึงมีผลึกรูปทรงเรขาคณิตที่แน่นอน แต่อาจแตกต่างกันไปตามชนิดของสาร สารประเภทนี้มีจุดหลอมเหลวคงที่เพราะแรงยึดเหนี่ยวระหว่างอนุภาคสม่ำเสมอกันทั่วทั้งสาร เช่น ควอตซ์


การจัดเรียงอนุภาคของของแข็ง
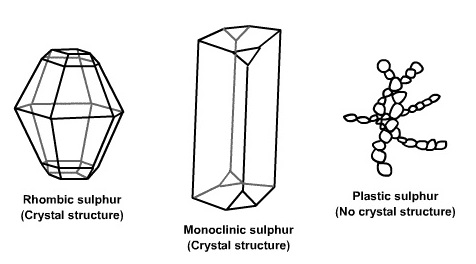
ธาตุบางชนิดมีการจัดเรียงตัวของอะตอมในโครงสร้างโมเลกุลได้หลายแบบ จึงมีรูปผลึกต่างกันเรียกว่าอัญรูปหรือรูป (allotrope) เช่น กำมะถันมีโครงสร้างผลึก 2 แบบ คือรอมบิก (rhombic) และมอนอคลินิก(monoclinic) โครงสร้างดังกล่าวนี้สามารถเปลี่ยนจากแบบหนึ่งไปอีกแบบหนึ่งได้ที่อุณหภูมิ และความดันค่าหนึ่ง เรียกภาวะนี้ว่า จุดแทรนซิชัน (transition point) กำมะถันชนิดรอมบิกและมอนอคลินิกมีลักษณะดังรูป

กำมะถันรอมบิก กำมะถันมอนอคลีนิค
โครงสร้างของกำมะถันแบบรอมบิกประกอบด้วยอะตอมของกำมะถัน 8 อะตอม (S8) ดังรูป

ขณะที่อุณหภูมิต่ำกำมะถันจะอยู่ในรูปรอมบิก ถ้ามองจากด้านข้างจะมีรูปทรงคล้ายมงกุฎ (clown form รูปขวา ) ถ้ามองจากด้านบนจะเห็นเป็นรูป 8 เหลี่ยม โดยมีโครงสร้างโมเลกุลประกอบด้วยซัลเฟอร์ 8 อะตอม
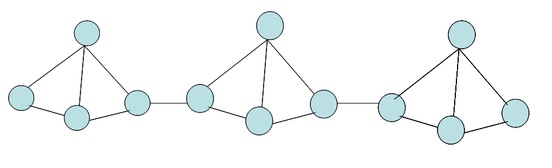
( S8 ) เหมือนกัน แต่เมื่ออุณหภูมิสูงขึ้นจะเปลี่ยนรูปเป็นมอนอคลินิก มีลักษณะเป็นผลึกรูปเข็ม แต่ถ้าให้ความร้อนสูงขึ้นอีกพันธะจะเกิดการแยกสลาย กลายเป็นโครงสร้างที่มีลักษณะเป็นสาย (chain) ไม่มีรูปผลึก จากนั้นแต่ละสายอาจเกาะเกี่ยวพันกันทำให้ข้น หนืด คล้ายพลาสติก จึงเรียกว่ากำมะถันพลาสติก ดังรูป
ถ้าความร้อนสูงมากสายของโมเลกุลอาจจะขาดออกเป็นช่วงสั้น ๆ ทำให้ระเหยเป็นไอได้ง่ายขึ้น ไอของกำมะถันจะประกอบด้วยโมเลกุลของ S8 ,S4 , S2 ขึ้นอยู่กับอุณหภูมิ

จุดแทรนซิชันของกำมะถันอยู่ที่อุณหภูมิ 96 oC ดังรูป

ฟอสฟอรัสเป็นอีกธาตุหนึ่งที่มีหลายอัญรูปหรือหลายรูป ที่สำคัญมี 4 ชนิด คือ ฟอสฟอรัสขาว,ฟอสฟอรัสแดง ฟอสฟอรัสดำ และฟอสฟอรัสม่วง ดังรูป

ฟอสฟอรัสขาว มีลักษณะนิ่มคล้ายขี้ผึ้งสีขาวมีสูตรโมเลกุลเป็น P4 รูปร่างเป็นทรงสี่หน้าแต่ไม่มีอะตอมกลาง มีแรงดึงดูดระหว่างโมเลกุลอย่างอ่อนทำให้มีจุดหลอมเหลวต่ำและระเหยง่าย แม้ที่อุณหภูมิห้อง มีความเป็นพิษสูง และถูกออกซิไดซ์โดยออกซิเจนในอากาศได้ง่าย ทำให้เกิดการติดไฟลุกไหม้ได้เอง ที่อุณหภูมิห้อง 40 - 45 oC เกิดสารประกอบออกไซด์ P4O10 ขึ้นมา โดยทั่วไปจะไปเก็บรักษาโดยการแช่ไว้ในน้ำ ฟอสฟอรัสไม่ละลายน้ำแต่ละลายใน CS2 , C6H6 หรือตัวทำละลายอินทรีย์อื่น ๆ

P4 (ฟอสฟอรัสขาว) P4O10 (ออกไซด์ของฟอสฟอรัส)
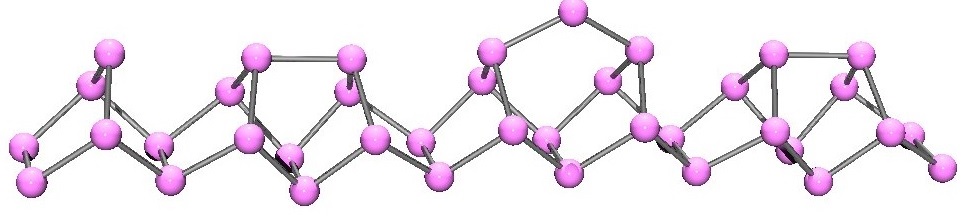
ฟอสฟอรัสแดง คือ พอลิเมอร์ของฟอสฟอรัสขาว เกิดจากการนำฟอสฟอรัสขาวมาเผาหรือทิ้งไว้นานๆทำให้ P4 สร้างพันธะเชื่อมต่อกันเป็นสายโซ่ มีลักษณะเป็นผงสีแดงแก่ ไม่ละลายใน CS2 หรือตัวทำละลายอินทรีย์ใด ๆไม่ระเหย ไม่เป็นพิษและไม่ว่องไวต่อปฏิกิริยาไม่สามารถลุกไหม้ได้เองที่อุณหภูมิต่ำกว่า 240 oC สามารถระเหิดได้ที่อุณหภูมิประมาณ 420 oC มีโครงสร้างแบบโครงตาข่าย ใช้ทำผิวกล่องไม้ขีดไฟ
ฟอสฟอรัสแดง
ฟอสฟอรัสดำ มีโครงร้างและสมบัติคล้ายแกรไฟต์ คือ เป็นของแข็งสีเทาแก่มีเงาคล้ายโลหะ เป็นแผ่นสามารถนำไฟฟ้าและความร้อนได้ โครงสร้างเป็นแผ่นๆ คล้ายแกรไฟต์ อะตอมของฟอสฟอรัสในชั้นเดียวกันต่อกันด้วยพันธะโคเวเลนต์ แต่ชั้นของฟอสฟอรัสดำไม่แบนราบมีการหยักขึ้นลงต่างจากแกรไฟต์ที่แบนราบ ฟอสฟอรัสดำเป็นอัญรูปที่เสถียรที่สุดของฟอสฟอรัส การเตรียมฟอสฟอรัสดำทำได้โดยนำฟอสฟอรัสขาวมาให้ความร้อน โดยใช้อุณหภูมิสูงเกิน 450 oC หรือทิ้งไว้นานๆ สามารถเปลี่ยนเป็นฟอสฟอรัสดำได้เอง

ฟอสฟอรัสดำ
ฟอสฟอรัสม่วง (violet phosphorus, Hittorf's Metallic Phosphorus) เกิดจากการนำฟอสฟอรัสแดงไปให้ความร้อน 550 oC ขึ้นไปเป็นเวลา 1-2 สัปดาห์ ทำให้อะตอมเกิดการจัดเรียงตัวกันใหม่กลายเป็นฟอสฟอรัสม่วง มีโครงสร้างดังรูป
การเปลี่ยนรูปของฟอสฟอรัสเป็นดังแผนภาพต่อไปนี้

- 1 บาร์ ≈ 0.98692 บรรยากาศ (atm)
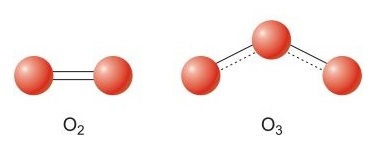
ออกซิเจนมี 2 รูป คือ O2 (แก๊สออกซิเจน) และ O3 (แก๊สโอโซน)
คาร์บอนมีรูปที่สำคัญคือ ถ่าน แกรไฟต์ เพชร ฟุลเลอรีน

(คลิ้กชมโครงสร้างของแกรไฟต์)
(คลิ้กชมโครงสร้างของฟุลเลอรีน)
(คลิกชมโครงสร้างของแกรไฟต์และเพชร)
ชนิดของผลึก
ของแข็งที่อยู่ในรูปผลึกมีการจัดเรียงอนุภาคภายในอย่างมีระเบียบในสามมิติ มีโครงสร้างทางเรขาคณิตที่แน่นอน แต่ละอนุภาคยึดเหนี่ยวกันด้วยแรงชนิดต่าง ๆ อย่างสม่ำเสมอของแข็งบริสุทธิ์จึงมีจุดหลอมเหลวเฉพาะตัวและคงที่ ถ้าใช้แรงยึดเหนี่ยวระหว่างอนุภาคภายในผลึกเป็นเกณฑ์ สามารถจำแนกประเภทของผลึกได้ 4 ประเภท ดังนี้
1. ผลึกโมเลกุล (Molecular crystal)
ประกอบด้วยโมเลกุลซึ่งยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์ และหรือพันธะไฮโดรเจน ถ้าเป็นผลึกของโมเลกุลที่ไม่มีขั้ว แรงยึดเหนี่ยวระหว่างโมเลกุลจะเป็นแรงแวนเดอร์วาลส์ประเภทแรงลอนดอน เช่น แนพทาลีน น้ำแข็งแห้ง ถ้าเป็นของแข็งที่โมเลกุลมีขั้วจะยึดเหนี่ยวด้วยแรงดึงดูดระหว่างขั้ว หรือพันธะไฮโดรเจน เช่น น้ำแข็ง แอมโมเนียแข็ง ของแข็งที่เป็นผลึกโมเลกุลส่วนใหญ่จะมีลักษณะค่อนข้างอ่อนหรือแข็งปานกลาง มีจุดหลอมเหลวต่ำ ไม่นำไฟฟ้า ผลึกของโมเลกุลไม่มีขั้วบางชนิดระเหิดได้ง่าย เช่น แนพทาลีน

ผลึกน้ำแข็ง

โครงสร้างของผลึกน้้ำแข็ง
2. ผลึกโคเวเลนต์ร่างตาข่าย (Network covalent crystal)
ประกอบด้วยอะตอมที่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เช่น แกรไฟต์ เพชร ซึ่งมีอะตอมของคาร์บอนสร้างพันธะโคเวเลนต์กับอะตอมของคาร์บอนอื่นอีก 3 อะตอม และ 4 อะตอมตามลำดับเป็นสารที่มีโครงผลึกร่างตาข่าย ของแข็งประเภทนี้มีจุดหลอมเหลวสูง มีความแข็ง แต่ความแข็งจะมากหรือน้อยขึ้นอยู่กับการจัดเรียงอะตอมในโครงผลึกร่างตาข่าย

โครงสร้างของแกรไฟต์
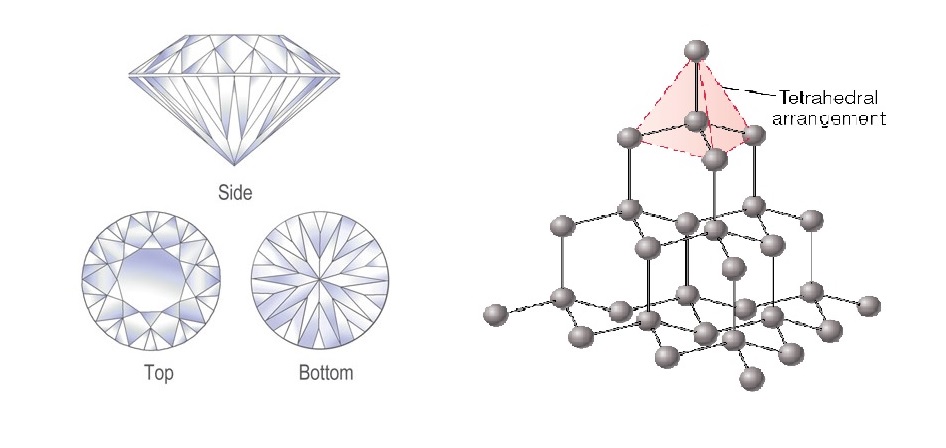
โครงสร้างของเพชร
3. ผลึกโลหะ (Metalic crystal)
ประกอบด้วยอะตอมของโลหะ ยึดเหนี่ยวกันด้วยพันธะโลหะซึ่งแข็งแรงมาก ของแข็งประเภทนี้ส่วนใหญ่มีความแข็งและเหนียว สามารถตีเป็นแผ่น บิดงอได้ เป็นตัวนำความร้อนและไฟฟ้าที่ดี แต่อย่างไรก็ตามผลึกโลหะบางชนิดอาจมีสมบัติไม่สอดคล้องตามที่กล่าวแล้ว เช่น ตะกั่วนำไฟฟ้าได้ไม่ดี ของแข็งประเภทนี้ส่วนใหญ่จะมีจุดหลอมเหลว ค่อนข้างสูงและแตกต่างกันไปตามความแข็งแรงของพันธะโลหะ แต่ก็มีผลึกโลหะบางชนิดที่มีลักษณะค่อนข้างอ่อน มีจุดเดือดและจุดหลอมเหลวต่ำ เช่น โลหะหมู่ IA และ IIA

โลหะแต่ละชนิดจะมีรูปผลึกเฉพาะตัวต่าง ๆ กันไป เช่น

4. ผลึกไอออนิก (Ionic crystal)
ประกอบด้วยไอออนบวกและไอออนลบที่มีขนาดไอออนแตกต่างกัน และยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้า ของแข็งประเภทนี้จึงมีลักษณะแข็งแต่เปราะ มีจุดหลอมเหลวและจุดเดือดสูง เมื่อเป็นของแข็งจะไม่นำไฟฟ้า แต่จะนำไฟฟ้าได้เมื่อหลอมเหลวหรือเป็นสารละลาย เช่น ผลึก NaCl มีโครงสร้างดังรูป

(คลิ้กชม สมบัติของแข็งและตอบคำถาม )
การเปลี่ยนสถานะของของแข็ง
เมื่อของแข็งได้รับความร้อนจะทำให้อนุภาคของของแข็งมีพลังงานมากขึ้น เมื่ออนุภาคมีพลังงานมากกว่าแรงยึดเหนี่ยวระหว่างอนุภาค ของแข็งก็จะเกิดการเปลี่ยนสถานะ โดยเป็นไปได้ 2 แบบ คือการหลอมเหลว (melt) กับการระเหิด (sublimation)
การหลอมเหลว (melt)
เมื่อให้ความร้อนแก่ของแข็ง อนุภาคของของแข็งจะมีพลังงานจลน์เพิ่มขึ้น ทำให้อนุภาคมีการสั่นมากขึ้น และมีการถ่ายโอนพลังงานให้แก่อนุภาคข้างเคียงอย่างต่อเนื่อง จนกระทั่งบางอนุภาคมีพลังงานสูงกว่าแรงยึดเหนี่ยวระหว่างอนุภาค อนุภาคดังกล่าวจะเคลื่อนที่ได้ อนุภาคที่เคลื่อนที่เป็นปรากฏการณ์ของการหลอมเหลว (melting) เรียกอุณหภูมิในขณะที่ของแข็งกำลังของเหลวว่า จุดหลอมเหลว (melting point) ขณะที่ของแข็งยังหลอมเหลวไม่หมดอุณหภูมิจะคงที่อยู่ ณ จุดหลอมเหลว (จุดเยือกแข็ง) ของสารนั้น ที่เป็นดังนี้เป็นเพราะในขณะนั้นจะมีสารอยู่ทั้ง 2 สถานะพร้อมกันคือส่วนที่เป็นของแข็งที่ยังหลอมเหลวไม่หมด กับส่วนที่เป็นของเหลวแล้ว ในภาวะนี้ทั้ง 2 สถานะมีอุณหภูมิเท่ากัน แต่พลังงานจลน์ไม่เท่ากัน ส่วนที่เป็นของแข็งมีพลังงานจลน์ต่ำกว่าส่วนที่เป็นของเหลว การให้ความร้อนในช่วงนี้อุณหภูมิจะไม่เพิ่มขึ้น เพราะธรรมชาติของความร้อนจะเดินทางไปยังบริเวณที่มีพลังงานต่ำ ฉะนั้นแม้ว่าระบบจะยังคงได้รับความร้อน ความร้อนจะเข้าไปสู่ส่วนของของแข็งที่ยังหลอมเหลวไม่หมดเพราะเป็นส่วนที่มีพลังงานต่ำกว่า ทำให้เกิดการหลอมเหลวไปเรื่อย ๆ จนกว่าจะหลอมเหลวหมด จากนั้นถ้าระบบยังคงได้รับความร้อนอย่างต่อเนื่อง ความร้อนเดินทางเข้าไปในของเหลวที่เพิ่งผ่านการหลอมเหลวมาใหม่ ๆ และยังมีอุณหภูมิเท่ากับอุณหภูมิ ณ จุดหลอมเหลว (จุดเยือกแข็ง) ดังกล่าวมาแล้ว ทำให้ของเหลวมีอุณหภูมิสูงขึ้น ถ้ามีปริมาณความร้อนเพียงพออุณหภูมิก็จะสูงขึ้นไปจนถึงจุดเดือดของของเหลวนั้น ถ้าดูในแผนผังวัฏภาคก็คือจุดใดจุดหนึ่งบนเส้นแบ่งเขตวัฏภาคระหว่างของแข็งกับของเหลว เรียกปริมาณความร้อนที่ใช้ในการหลอมเหลวของสารต่าง ๆ ว่าความร้อนแฝงของการหลอมเหลว (Latent Heat Melting , Latent Heat Fusion) มีหน่วยเป็น cal/g หรือ Jule/g สารแต่ละชนิดมีค่าความร้อนดังกล่าวนี้เฉพาะตัว เช่น ความร้อนแฝงของการหลอมเหลวของน้ำแข็ง = 80 cal/gหรือ 336 Jule/g ของแข็งที่มีค่าความร้อนแฝงของการหลอมเหลวสูงแสดงว่ามีแรงยึดเหนี่ยวระหว่างอนุภาคมาก จึงทำให้มีจุดหลอมเหลวสูง
การคิดคำนวณเกี่ยวกับปริมาณความร้อน คิดจากสมการ ; Q = mL
กำหนดให้ ; Q = ปริมาณความร้อน
m = มวลของสาร (กรัม)
L = ความร้อนแฝงของการหลอมเหลว (แคลอรี/กรัม หรือ จูล/กรัม )
(คลิ้กชม แสดงการเปลี่ยนสถานะของสาร)
ตัวอย่าง ความร้อนแฝงของการหลอมเหลวและจุดหลอมเหลวของสารบางชนิด
|
Substance
|
Latent Heat
Fusion
kJ/kg
|
Melting
Point
°C
|
|
Alcohol, ethyl
|
108
|
−114
|
|
Ammonia
|
339
|
−75
|
|
Carbon dioxide
|
184
|
−78
|
|
Hydrogen(2)
|
58
|
−259
|
|
Lead
|
24.5
|
327.5
|
|
Nitrogen
|
25.7
|
−210
|
|
Oxygen
|
13.9
|
−219
|
|
Toluene
|
72.1
|
−93
|
|
Water
|
334
|
0
|
(คลิ้กชมแสดงความร้อนแฝงของการหลอมเหลวและการกลายเป็นไอ)
การระเหิด (Sublimation)
การระเหิดเป็นการเปลี่ยนสถานะจากของแข็งกลายเป็นไอโดยไม่ต้องผ่านการเป็นของเหลว การเปลี่ยนแปลงนี้เกิดได้กับของแข็งบางชนิดที่โมเลกุลไม่มีขั้วหรือมีขั้วน้อยมาก แรงยึดเหนี่ยวระหว่างอนุภาคจึงเป็นแรงแวนเดอร์วาลส์ (Van der Waals forces) อย่างอ่อน เช่น แรงลอนดอน (London forces) เมื่ออนุภาคของสารได้รับความร้อนจากสิ่งแวดล้อมเพียงเล็กน้อย จะทำให้อนุภาคที่อยู่บริเวณผิวหน้าของผลึกแยกตัวออกจากผลึก กลายเป็นไอโดยไม่มีการหลอมเหลว เช่น การระเหิดของไอโอดีน การระเหิดของแนพทาลีน การบูร เมนทอล เป็นต้น
(คลิ้กชมการเปลี่ยนสถานะทำแบบฝึกหัด)
รูปภาพที่เกี่ยวข้อง

Size : 30.72 KBs
Upload : 2014-02-10 05:42:19
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|