ปริมาณสารสัมพันธ์ ตอนที่ 8 การเตรียมสารละลาย
การเตรียมสารละลาย
มีการใช้สารละลายกันอย่างกว้างขวางในวงการต่าง ๆ ทั้งในชีวิตประจำวัน ทางการแพทย์ ทางอุตสาหกรรม ทางการเกษตร และอื่น ๆ การเตรียมสารละลายใด ๆ
จำเป็นต้องทราบข้อมูลพื้นฐานต่อไปนี้
- ทราบชนิดของตัวทำละลายและตัวละลาย
- ทราบหน่วยความเข้มข้นของสารละลายที่ต้องการ
- ทราบปริมาณของสารละลายที่ต้องการ
เครื่องมือที่เกี่ยวข้องกับการเตรียมสารละลาย
การเตรียมสารละลายให้ได้มาตรฐาน จำเป็นต้องมีเครื่องมือที่ได้มาตรฐานด้วย แต่ถ้าเป็นการเตรียมสารละลายทั่ว ๆ ไป สามารถประยุกต์ใช้เครื่องมือต่าง ๆ ได้
เครื่องมือที่จำเป็นต้องใช้ในการเตรียมสารละลายได้แก่ เครื่องชั่งอย่างดี (balance) ขวดวัดปริมาตร (volumetric flask) กรวย (funnel) บีกเกอร์ (beaker)
ขวดน้ำกลั่น (distillation water bottle ) และเครื่องมืออำนวยความสะดวกอื่น ๆ

balance

volumetric flask
 
funnel distillation water bottle
การเตรียมสารละลายทำได้ 3 วิธี ดังนี้
1. โดยการผสมตัวละลายกับตัวทำละลายโดยตรงเพื่อให้ได้สารละลายที่มีความเข้มข้นและปริมาณที่ต้องการ เช่น ถ้าต้องการเตรียมสารละลาย NaCl ความเข้มข้น 0.25 โมล/ลิตร
จำนวน 500.0 cm3 มีขั้นตอนดังนี้
- หาน้ำหนักของ NaCl ที่ต้องใช้ ;
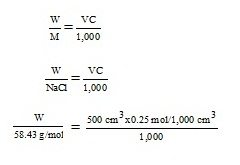
W = 7.304 g
เตรียมสารละลายดังกล่าวดังนี้
1. ชั่ง NaCl = 7.304 g
2. ละลายในน้ำกลั่นให้ได้ละลาย 500.0 cm3 สารละลาย NaCl ที่ได้จะมีความเข้มข้น 0.25โมล/ลิตร ตามต้องการ
(คลิ้ก ชมแอนิเมชันแสดงการเตรียมสารละลาย)
(คลิ้ก ชมวีดีทัศน์แสดงการเตรียมสารละลาย ,ไฟล์ใหญ่ Net ช้าต้องรอนาน)
(คลิ้ก ชมวีดีทัศน์แสดงเตรียมสารละลาย)
(คลิ้ก ชมวีดีทัศน์เตรียมสารละลาย)
2. โดยการนำสารละลายที่มีอยู่แล้วมาทำให้เจือจาง (dilute a solution) เพื่อให้ได้สารละลายที่มีความเข้มข้นและปริมาณที่ต้องการ
เรียกสารละลายที่มีอยู่แล้วว่า stock solution ซึ่งควรเป็นสารละลายที่มีความเข้มข้นมาก ๆ เมื่อต้องการใช้สารละลายที่เจือจางกว่า เราสามารถนำ stock solution
มาเตรียมสารละลายที่ต้องการได้ จากข้อ 1 เราเตรียมสารละลาย NaCl ความเข้มข้น 0.25 โมล/ลิตร จำนวน 500.0 cm3 เอาไว้แล้ว ถ้าเราต้องการเตรียมสารละลาย NaCl
ความเข้มข้นที่มีความเข้มข้นน้อยกว่านั้น เราทำได้โดยนำสารละลายดังกล่าวมาเจือจาง เช่น ถ้าต้องการเตรียมสารละลาย NaCl ความเข้มข้น 0.01 โมล/ลิตร จำนวน 0.250 dm3
หรือ 250 cm3 จะทำได้ดังนี้ (ถ้าคิดจาก V เป็น cm3)
- หาจำนวนโมลของ NaCl ที่ต้องการใช้ ;

- ใช้ปีเปตตวง stock solution มา 10.0 cm3 ใส่ในขวดวัดปริมาตร เติมน้ำกลั่นจนมีปริมาตร 250 cm3 เขย่าให้เข้ากัน จะได้สารละลาย NaCl ความเข้มข้น
0.01 โมล/ลิตร จำนวน 250 cm3 ตามต้องการ
(ถ้า V เป็น dm3)

*** คิดโดยสูตร ใช้หลักการว่า จำนวนโมลของตัวละลายจาก stock solution ที่นำมาใช้ = จำนวนโมลของตัวละลายในสารละลายที่เตรียมขึ้นใหม่

(คลิ้ก ชมแอนิเมชันแสดงการเตรียมสารละลายเสมือนจริง)
(คลิ้ก ชมวีดีทัศน์แสดงการเตรียมสารละลายแบบ dilution)
(ชมแอนิเมชันการเตรียมสารละลายแบบ dilution)
3. โดยการผสมสารละลายชนิดเดียวกันแต่มีความเข้มข้นต่างกัน กลายเป็นสารละลายชนิดใหม่ที่มีความเข้มข้นและปริมาณที่ต้องการ
ตัวอย่าง มีสารละลาย NaCl ชนิดที่ 1 มีความเข้มข้น 0.250 โมล/ลิตร จำนวน 500.00 cm3 และสารละลาย NaCl ชนิดที่ 2 มีความเข้มข้น 0.01 โมล/ลิตร จำนวน 250 cm3
ถ้าต้องการเตรียมสารละลาย NaCl ชนิดใหม่ให้มีความเข้มข้น 0.10 โมล/ลิตร จำนวน 200 cm3 โดยการผสมจากสารละลายที่มีอยู่แล้วจะมีขั้นตอนอย่างไร
วิธีทำ สมมติว่า ใช้สารละลาย NaCl ชนิดที่ 1 = x cm3
ฉะนั้นต้องใช้สารละลาย NaCl ชนิดที่ 2 เท่ากับ 200-x cm3

การเตรียมสารละลายที่ต้องการทำได้โดย ตวงสารละลาย NaCl ชนิดที่ 1 จำนวน 76.92 cm3 ตวงสารละลาย NaCl ชนิดที่ 2 จำนวน 200-76.92 = 123.08 cm3
นำมาผสมให้เป็นเนื้อเดียวกัน จะได้สารละลาย NaCl ที่มีความเข้มข้น 0.10 โมล/ลิตร จำนวน 200 cm3 ตามต้องการ
** ใช้สูตรหรือสมการทั่วไป C1V2 + C2V2 + CnVn = CtVt
(Ct = ความเข้มข้นของสารละลายผสม Vt = ปริมาตรของสารละลายผสม)
(คลิ้ก ชมแอนิเมชันทบทวนและทดสอบ)
แบบฝึกหัด
1. (ENT’26) ถ้าต้องการเตรียมสารละลาย Hg(NO)2 1000 cm3 ให้มีความเข้มข้นของ Hg2+ อยู่เป็นปริมาณ 2% มวล/ปริมาตร จะต้องใช้ Hg(NO)2 กี่กรัม
(Hg=200.6 O=16 N=14)
1. 20.0 2. 25.97 3. 32.4 4. 55.2
2. ในการเตรียมสารละลาย CaCl2 ให้มีความเข้มข้น 5% โดยมวล/ปริมาตร จำนวน 100cm3 ต้องใช้ CaCl2.H2O และน้ำอย่างละกี่กรัม ตามลำดับ (ENT’36)
(Ca=40 Cl=35.5 O=16 H=1)
1. 2.5,97.5 2. 5,95 3. 5.81 , 94.19 4. 9.9,90.1
3. (ENT’39) มีสารละลาย NaCl เข้มข้น ร้อยละ 12 โดยมวลต่อปริมาตร จำนวน 200 cm3 ถ้าต้องการเปลี่ยน สารละลายนี้ให้มีความเข้มข้นเป็นร้อยละ 16 (ในหน่วยความเข้มข้นเดิม)
จำนวน 250 cm3 จะต้องเติม NaCl อีกกี่กรัม
4. ต้องการเตรียมสารละลาย NaCl เข้มข้น 15%โดยมวล จะต้องใช้ NaCl กี่กรัมเพื่อเตรียมสารละลาย 100 กรัม
1. 8 2. 12 3. 17.65 4. 20
5. มี MgSO4.5H2O อยู่ 21 กรัม จะเตรียมสารละลาย MgSO4 ให้มีความเข้มข้น 0.1 โมล/ลิตร ได้ไม่เกินกี่ cm3
6. มีสารละลายน้ำตาลกลูโคสความเข้มข้น 1 โมล/ลิตร จำนวน 100 cm3 แต่ต้องการเปลี่ยนความเข้มข้นให้เป็น 0.4 โมล/ลิตร โดยเติมสารละลายกลูโคสชนิดเข้มข้น 0.1 โมล/ลิตร
ลงไป อยากทราบว่าจะต้องเติมสารละลายกลูโคสชนิดเข้มข้น 0.1 โมล/ลิตร จำนวนกี่ cm3
7. (PAT.2 ต.ค. 52) ถ้าต้องการเตรียมสารละลาย Zn2+ เข้มข้น 0.40 โมลาร์ โดยการเตรียมจากการละลายโลหะ Zn หนัก 13.00 กรัมด้วยสารละลายกรด HCl
ต้องละลายโลหะ Zn ลงในสารละลาย HCl ที่มีความเข้มข้นและปริมาตรตามข้อใด (Zn=65 Cl=35.5 H=1) (ตอบ 1)
1. 0.40 โมลาร์ 500 มิลลิลิตร 2. 0.80 โมลาร์ 1,000 มิลลิลิตร
3. 1.20 โมลาร์ 500 มิลลิลิตร 4. ไม่มีข้อใดถูก
8. (PAT.2 มี.ค. 52) มีสารละลายกรด HCl เข้มข้น 0.40 โมลาร์ จำนวน 500 มิลลิลิตร และสารละลายกรด HCl เข้มข้น 0.10 โมลาร์ จำนวน 500 มิลลิลิตร
ต้องการเตรียมสารละลายกรด HCl เข้มข้น 0.20 โมลาร์ จำนวน 500 มิลลิลิตร วิธีเตรียมต่อไปนี้ข้อใดถูกต้อง
1. ใช้สารละลายกรด HCl เข้มข้น 0.40 โมลาร์ จำนวน 200 มิลลิลิตร ผสมกับสารละลาย กรด HCl เข้มข้น 0.10 โมลาร์ จำนวน 300 มิลลิลิตร
2. ใช้สารละลายกรด HCl เข้มข้น 0.40 โมลาร์ จำนวน 300 มิลลิลิตร ผสมกับสารละลายกรด HCl เข้มข้น 0.10 โมลาร์ จำนวน 200 มิลลิลิตร
3. ใช้สารละลายกรด HCl เข้มข้น 0.40 โมลาร์ จำนวน 200 มิลลิลิตร ผสมกับสารละลายกรด HCl เข้มข้น 0.10 โมลาร์ จำนวน 200 มิลลิลิตร
แล้วเติมน้ำ 100 มิลลิลิตร
4. ใช้สารละลายกรด HCl เข้มข้น 0.40 โมลาร์ จำนวน 200 มิลลิลิตร ผสมกับสารละลายกรด HCl เข้มข้น 0.10 โมลาร์ จำนวน 100 มิลลิลิตร
แล้วเติมน้ำ 200 มิลลิลิตร
9. (ENT’19) ถ้าต้องการเตรียมสารละลาย HCl เข้มข้น 1 M ( หรือ mol/dm3 ) จำนวน 50 cm3 จากสารละลาย HCl เข้มข้น 4 M จำนวน จะต้องการน้ำกี่ cm3
มาผสมกับสารละลายกรดชนิด 4 M
1. 12.5 2. 20 3. 37.5 4. 46
10. (ENT’21) สารละลายชนิดหนึ่ง 100cm3 เข้มข้น 3 mol/dm3 ถ้าต้องการทำให้มีความเข้มข้นเป็น 2 mol/dm3 จะต้องเติมน้ำจนมีปริมาตรเท่าใด
1. 600 cm3 2. 300 cm3 3. 200 cm3 4. 150 cm3
11. (ENT’22) มีสารละลาย NaOH 1 mol/dm3 จำนวน500cm3 ถ้าแบ่งมา 100 cm3 แล้วทำให้เจือจางเป็น 1 ลิตร จะมี NaOH กี่ mol
1. 0.01 2. 0.1 3. 0.2 4. 0.5
12. (ENT’23) มีสารละลายกรด H2SO4 เข้มข้น 0.2 mol/dm3 อยู่500 cm3 ถ้าต้องการเตรียมกรด H2SO4 ให้เข้มข้น 0.03 mol/dm3 จำนวน 100 cm3
จะต้องใช้กรด H2SO4 กี่ cm3
1. 1.5 2. 3 3. 15 4. 30
13. (ENT’24) สารละลายชนิดหนึ่งเข้มข้น 1 mol/dm3 มีปริมาตร 0.2 dm3 เมื่อเติมน้ำกลั่นลงไป 0.3 dm3 ความเข้มข้นจะเปลี่ยนเป็นกี่ mol/dm3
1. 0.67 2. 0.4 3. 0.1 4. 0.06
14. (ENT’29) สารละลาร A เตรียมได้จากการละลาย Na2CO3 5.3 กรัม ในน้ำ 250 cm3 ถ้าต้องการเตรียม Na2CO3 เข้มข้น 0.01 mol/dm3 จำนวน 500cm3
จะต้องนำ สารละลาย A มาเท่าใด
1.15 cm3 2. 20 cm3 3. 25 cm3 4. 30 cm3
15. (ENT’31) สารละลายมี NaOH 4.8 g/dm3 ถ้านำมา 100cm3 เพื่อทำให้เป็นสารละลายเข้มข้น 0.1 mol/dm3 จะต้องเติมน้ำจนปริมาตรรวมทั้งหมดกี่ cm3
1. 110 2. 120 3. 200 4. 210
16. (ENT’31) สารละลายกรด HCl เข้มข้น 36.5% มวลต่อมวล มีความหนาแน่น 1.15 g/cm3 ถ้าต้องการเตรียมกรด HCl เข้มข้น 0.23 mol/dm3 จำนวณ 250 cm3
ต้องใช้กรด HClกี่ cm3
1. 2.5 2. 22 3. 7.5 4. 10
17. (ENT’38) ถ้าต้องการเตรียมกรด HCl เข้มข้น 0.5 mol/dm3 จำนวณ 100 cm3 จากกรดเข้มข้น 36 %โดยมวลซึ่งมีความหนาแน่น 1.2 g/cm3จะต้องใช้กรดเข้มข้นกี่ cm3
1. 4.22 2. 5.07 3. 5.52 4. 6.08
18. (PAT.2 มี.ค. 53) ถ้าต้องการเตรียมสารละลายไทเทเนียมซัลเฟต ปริมาตร 100 มิลลิลิตร ให้มีความเข้มข้น 10 มิลลิกรัม/ลิตร ต้องใช้ TiSO4 กี่กรัม (Ti=48)
1. 3.0 x 10-1 2. 3.0 x 10-2 3. 3.0 x 10-3 4. 3.0 x 10-4
19. (PAT.2 มี.ค. 53) ถ้าต้องการเตรียมสารละลายกรด H2SO4 0.90 โมลาร์ ปริมาตร 250 มิลลิลิตร ต้องใช้กรด H2SO4 ที่มีความเข้มข้นร้อยละ 98 โดยมวล
กี่มิลลิลิตร (กำหนดความหนาแน่นของกรด H2SO4 เป็น 1.80 กรัม/มิลลิลิตร)
1. 6.30 2. 12.50 3. 18.00 4. 25.00
คำชี้แจง ข้อมูลต่อไปนี้ใช้ประกอบการตอบคำถามข้อ 20-21 (ENT’33)
เมื่อผสมสารละลาย NaOH เข้มข้น 0.4 mol/dm3 จำนวน 30 cm3 กับสารละลาย NaOH เข้มข้น 0.3 mol/dm3 จำนวน 20 cm3
20. สารละลายมีความเข้มข้น กี่โมล/ลิตร
1. 0.35 2. 0.36 3. 0.70 4. 0.72
21. เมื่อผสมแล้วเติมนํ้ากลั่นจนสารละลายมีปริมาตร 250 cm3 ความเข้มข้นของสารละลายที่ได้จะเป็นกี่ mol/dm3
1. 0.35 2. 0.175 3. 0.09 4. 0072
22. (ENT’32) ถ้านำสารละลายนํ้าตาลเข้มขัน 3 mol/dm3 จำนวน 2 dm3 มาผสมกับสารละลายน้ำตาลชนิดเดียวกันเข้มข้น 2.5 mol/dm3 จำนวน 3 dm3
แล้วเติมนั้าให้มีปริมาตรเป็น 10 dm3 ความเข้มข้นของน้ำตาลจะมีค่ากี่ mol/dm3
1. 13.5 2. 5.5 3. 1.5 4. 1.35
23. (ENT’20) ถ้าต้องการเตรียมสารละลายกรด HNO3 เข้มข้น 1 mol/dm3 ให้มีปริมาตร 14 ลิตร โดยการเติมกรดไนตริกเข้มข้น 15 mol/dm3
ลงในกรดไนตริกเข้มข้น 2 mol/dm3 จำนวน 1250 cm3 จะใช้กรดไนตริก 15 mol/dm3 กี่ลิตร
1. 12.958 2. 12.75 3. 7.67 4. 0.767
24. (ENT’36) ถ้าสารละลายโพแทสเซียมเปอร์แมงกาแนตมีความเข้มข้น 2.63 % โดยมวลและความถ่วงจำเพาะ 1.2 จะต้องนำสารละลายนี้มากี่ cm3
เพื่อเตรียมสารละลายโพแทสเซียมให้มีความเข้มข้น 0.01 mol/dm3 200 cm3
1. 5 cm3 2. 10 cm3 3. 15 cm3 4. 20 cm3
25. (ENT’39) ถ้าต้องการเตรียมสารละลายกร HNO3 เข้มข้น 2 mol/dm3 จำนวน 210 cm3 จากกรด HNO3 เข้มข้น 63 % โดยมวล (ความหนาแน่น 1.4 g/cm3)
จะต้องใช้กรด HNO3 เข้มข้น 63 % โดยมวลนี้กี่ cm3
1. 20 2. 25 3. 30 4. 35
26. (ENT’33) ในการเตรียมสารละลายที่มี Na+ เข้มข้น 0.4 mol/dm3 จำนวน 15 dm3 จากสารละลายNa3PO4 เข้มข้น 0.5 จะต้องใช้สารละลาย Na3PO4 ปริมาตรเท่าใด
1. 1200 cm3 2. 40 cm3 3. 400 cm3 4.120 cm3
27. (ENT’37) นำสารละลาย BaCl2 6 mol/dm3 มา x cm3 เติมน้ำลงไป y cm3 ได้สารละลาย BaCl2 ที่มีความเข้มข้นลดลงเป็น0.25 mol/dm3 มีปริมาตรรวม 300 cm3
ค่า x และ y ในข้อใดถูกต้อง
1. x = 12.5, y = 287.5 2. X = 25, y = 275
3. X = 37.5, y = 262.5 4. X = 50, y = 250
28. (ENT’28) จะต้องการเติมน้ำลงในสารละลายคอปเปอร์(II)ซัลเฟต (CuSO4) ที่มีความเข้มข้น 16 กรัม / ลิตร 200cm3 กี่ cm3 เพื่อให้ได้สารละลายคอปเปอร์(II) ซัลเฟต
ที่มีความเข้มข้นเป็น 0.01 mol/dm3
1. 200 2. 1800 3. 2000 4. 2200
29. จะต้องตวงสารละลาย HCl เข้มข้นปริมาตรเท่าใดเพื่อเตรียมสารละลาย HCl เข้มข้น 12.0 % โดยมวล จำนวน 50 cm3 ความเข้มข้นของสารละลาย HCl เข้มข้นคือ 37.2% โดยมวล
มีความหนาแน่น 1.19 g/cm3 ส่วนสารละลาย HCl เข้มข้น 12.0 % มีความหนาแน่น 1.11 g/cm3 (ตอบ 15.0 cm3)
30. จะต้องใช้สารละลาย H2SO4 เข้มข้น 10.0 M ปริมาตรเท่าใด เพื่อเตรียมสารละลาย H2SO4 เข้มข้น 0.2 M จำนวน 200 cm3 (ตอบ 4 cm3)
31. ของเหลวชนิดหนึ่งมีสูตร A3B มีค่าความถ่วงจำเพาะ 1.5 เมื่อนำ A3B 20 cm3 ผสมกับน้ำให้มีปริมาตรสุดท้ายเท่ากับ 500 cm3สารละลายที่ได้จะมีความเข้มข้นกี่ mol/dm3
(มวลอะตอม A = 33, B = 21)
1. 2.00 2. 1.50 3. 1.00 4. 0.50
32. จะต้องใช้สารละลาย H2SO4 ความเข้มข้น 96.0 % โดยน้ำหนัก (ความหนานแน่น 1.84 g cm-3) ปริมาตรกี่ cm3 ในการเตรียมสารละลาย H2SO4 ความเข้มข้น 1.50 M
จำนวน 8 dm3
33. ผสมสารละลายกรดชนิดเดียวกัน 2 ขวด ที่มีฉลากปิดว่า 0.1 M จำนวน 100 cm3 กับ 0.3 M จำนวน 100 cm3 อยากทราบว่าสารละลายที่ได้ใหม่จะมีความเข้มข้นกี่โมลาร์ (ตอบ 0.2)
34. ถ้าต้องการเตรียมสารละลาย NaIO3 เข้มข้น 0.5 M จำนวน 500. cm3 จะต้องชั่ง NaIO3 กี่กรัม
35. ต้องใช้ตัวละลายกี่กรัมในการเตรียมสารละลายต่อไปนี้
35.1 สารละลาย CaC2O4 ความเข้มข้น 5.24 X 10 –5 M จำนวน 1 ลิตร
35.2 สารละลาย NH4Cl ความเข้มข้น 2.00 M จำนวน 150 cm3
- (Ent.43 ต.ค.) อัตนัย ถ้าต้องการเตรียมสารละลาย CuSO4 เข้มข้น 0.1 mol/dm3 ปริมาตร 500 cm3 จาก CuSO4.5H2O ความบริสุทธิ์ร้อยละ 99.8
- จะต้องใช้ CuSO4.5H2O หนักกี่กรัม (Cu = 63.5 S=32 O=16 H=1)
Appendix
- Explain how to prepare 25 liters of a 0.10 M BaCl2 solution, starting with solid BaCl2. (Ba=137 Cl=35.5) (จงอธิบายวิธีเตรียมสารละลาย BaCl2
ให้มีความเข้มข้น 0.10 M จำนวน 25 ลิตร)
2. Determine the molarity of a solution made by dissolving 20.0 g of NaOH in sufficient water to yield a 482 cm3 solution. (ถ้าใช้ NaOH 20.0 g
ในการเตรียมเป็นสารละลาย 482 cm3 สารละลายดังกล่าวจะมีความเข้มข้นกี่โมลาร์)
3. How many moles of lithium chloride (LiCl) are needed to make 1 liter of 0.5 M LiCl solution? (Li=7)
(ในการเตรียมสารละลาย LiCl ความเข้มข้น 0.5 M จำนวน 1 ลิตร จะต้องใช้ LiCl กี่โมล)
4. How many mole of sodium hydroxide (NaOH) are needed to make 2 liters of 0.5 M NaOH?
(ในการเตรียมสารละลาย NaOH ความเข้มข้น 0.5 M จำนวน 2 ลิตร จะต้องใช้ NaOH กี่โมล)
5. How do you make 200 mL of a 0.1 M solution of hydrochloric acid (HCl) from a solution of 1.0 M HCl?
(ถ้าต้องการเตรียมสารละลายกรด HCl ความเข้มข้น 0.1 M จำนวน 200 mL จากสารละลายกรด HCl ความเข้มข้น 1.0 M จะมีวิธีการอย่างไร)
6. How do you make 2.0 liters of a 0.231 M solution of potassium nitrate (KNO3) from a 3.0 M solution of KNO3? (K=39 O=16 N=14)
; (ถ้าต้องการเตรียมสารละลายกรด KNO3 ความเข้มข้น 0.231 M จำนวน 2 ลิตร จากสารละลาย KNO3 ความเข้มข้น 3.0 M จะมีวิธีการอย่างไร)
7. Calculate the weight of potassium permanganate (KMnO4) needed to prepare 80 mL of a 0.01 M
solution. (K=39 Mn=55 O=16) ; (ในการเตรียมสารละลาย KMnO4 ความเข้มข้น 0.01 M จำนวน 80 mL จะต้องใช้ KMnO4 กี่กรัม)
8. A student wants to make 80 mL of a 1.0 M solution of sucrose (formula weight 342.3 g/mole). How much sucrose should he weigh out to
prepare this solution? ; ( นักเรียนคนหนึ่งต้องการเตรียมสารละลายซูโครส ความเข้มข้น1.0 M จำนวน 80 mL จะต้องใช้ซูโครสกี่กรัม (มวลโมเลกุลของซูโครส = 342.3 g/mole )
9. Calculate the amount of 0.01 M potassium permanganate (KMnO4) stock solution needed to prepare 25 mL of a 2 mM solution.
(Note that 2 mM = 0.002 M.) ; (ในการเตรียมสารละลาย KMnO4 ความเข้มข้น 2 mM จำนวน 25 mL จาก stock solution ซึ่งมีความเข้มข้น 0.01 M กำหนดให้ 2 mM = 0.002 M)
10. Calculate the amount of 1 M NaOH aqueous solution needed to make 100 mL of 0.5 M NaOH aqueous solution. (ในการเตรียมสารละลาย NaOH
ความเข้มข้น 0.5 M จำนวน 100 mL จากสารละลาย NaOH ความเข้มข้น 1 M จะต้องใช้สารละลาย NaOH ชนิด 1 M เท่าไร)
11. A 4 g sugar cube (sucrose: C12H22O11) is dissolved in a 350 ml teacup filled with hot water. What is the molarity of the sugar solution? ;
(น้ำตาลซูโครส 4 กรัม เมื่อทำเป็นสารละลาย 350 ml จะมีความเข้มข้นกี่โมลาร์)
12. How do we prepare 500 mL of a 0.5 percent w/v solution of NaOH if we have a stock solution of 50 percent w/v NaOH on hand ? ;
(มี stock solution ของ NaOH ความเข้มข้นร้อยละ 50 โดยมวล/ปริมาตร ถ้าต้องการเตรียมสารละลาย NaOH ความเข้มข้นร้อยละ 0.5 โดยมวล/ปริมาตร จำนวน 500 mL จะต้องทำอย่างไร)
13. You have a concentrated HCl solution labeled 6.0 M. How would you prepare 750 mL of 0.25 M HCl solution? ; (มีสารละลายกรด HCl ความเข้มข้น 6.0 M
ถ้าจะนำไปใช้เพื่อเตรียมสารละลาย HCl ความเข้มข้น 0.25 M จำนวน 750 mL จะมีวิธีอย่างไร)
14. If 0.456 g of NaF is dissolved in enough water to make 100 mL of solution, what is the molarity of the solution? ; (ถ้าใช้ NaF จำนวน 0.456 g
ทำให้เป็นสารละลาย 100 mL สารละลายจะมีความเข้มข้นกี่โมล/ลิตร)
15. You dissolved 10.0 g of sugar in 250 mL of water (the volume of a cup of coffee). Calculate the weight percentage of sugar in the solution.
Assume the density of solution to be 1.0 g/mL. ; (น้ำตาล 10.0 g ละลายในน้ำ 250 mL จงหาความเข้มข้นเป็นร้อยละโดยมวลของสารละลาย
สมมุติให้ความหนาแน่นของสารละลายคือ 1.0 g/mL )
16. You dissolved 10.0 g of sugar to make 250 mL of solution. Calculate the concentration in M. (Molar mass of sugar C12H22O11 = 342). ;
(น้ำตาลจำนวน 10.0 g ทำให้เป็นสารละลายปริมาตร 250 mL สารละลายมีความเข้มข้นกี่โมลาร์ ถ้ามวลโมเลกุลของน้ำตาล C12H22O11 = 342).
17. You dissolved 13.0 g of NaCl to make 2.00 L of solution. Calculate the molarity. Atomic wt: Na, 23.0; Cl, 35.5. (ใช้ NaCl 13.0 g
ทำให้เป็นสารละลาย 2.00 L สารละลายมีความเข้มข้นกี่โมล/ลิตร)
18. You diluted 10.00 mL of 6.0 M H2SO4 to prepare 250.0 mL solution. Calculate the concentration of this solution. Molar mass: H2SO4, 98.0 ;
(ใช้สารละลาย H2SO4 ความเข้มข้น 6.0 M จำนวน 10.00 mL มาทำให้เจือจางจนมีปริมาตร 250.0 mL จงหาความเข้มข้นของสารละลายนี้)
19. How much calcium bicarbonate Ca(HCO3)2 is present in 24.0 L of tap water if analysis indicates that the tap water contains 42.0 ppm Ca(HCO3)2?
Assume tap water density to be 1.00 g/mL. ; (น้ำก๊อกมีความเข้มข้นของ Ca(HCO3)2 เท่ากับ 42.0 ppm จงหาว่าน้ำก๊อกจำนวน 24.0 L มี Ca(HCO3)2 อยู่กี่กรัม)
20. A stock sulfuric acid solution contains 98.0 % of H2SO4, and its density is 1.840 g/mL. How many mL of this acid is required to prepare 5.0 L of 2.0 M
solution? Molar mass: H2SO4, 98.1. ; ( ถ้าต้องการเตรียมสารละลาย H2SO4 ความเข้มข้น 2 M จำนวน 5 L จาก stock solution H2SO4 ความเข้มข้น 98.0 %
ความหนาแน่น 1.840 g/mL จะต้องใช้ stock solution กี่ mL )
21. If you want to make 250.0 mL 0.100 M calcium chloride solution, how many moles of CaCl2 will you need? ; (ถ้าต้องการเตรียมสารละลาย CaCl2
ความเข้มข้น 0.100 M จำนวน 250.0 mL จะต้องใช้ CaCl2 กี่โมล)
22. If you want to make 250.0 mL of 0.100 M calcium chloride solution, how many grams of CaCl2 are needed? Molar mass: CaCl2, 111.1 g/mol. ;
((ถ้าต้องการเตรียมสารละลาย CaCl2 ความเข้มข้น 0.100 M จำนวน 250.0 mL จะต้องใช้ CaCl2 กี่กรัม ถ้ามวลสูตรของ CaCl2 = 111.1 g/mol)
23. What is the molarity of Na+ in a 0.123 M solution of Na2SO4? ; (ในสารละลาย Na2SO4 ความเข้มข้น 0.123 M มีความเข้มข้นของ Na+ กี่โมลาร์)
24. How many mL of 0.200 M aluminum chloride (AlCl3) solution will contain 6.00 millimole of Cl- ions? ; (ต้องนำสารละลาย AlCl3 ความเข้มข้น 0.200 M มากี่ mL
จึงจะมี Cl- ละลายอยู่ 6.00 มิลลิโมล)
25. How many mL of stock HNO3 solution (16.0 M) is required to make 400.0 mL 2.0 M solution? ; (ต้องการเตรียมสารละลาย HNO3 ความเข้มข้น 2.0 M
จำนวน 400.0 mL จะต้องใช้ stock solution ซึ่งเข้มข้น 16.0 M จำนวนกี่ mL)
26. Concentrated H3PO4 is 85.0% H3PO4 by mass and has a density of 1.70 g/mL. How many grams of this solution are required to
prepare 250.0 mL of a 2.00 M H3PO4 solution? (Atomic weights: H = 1.008, O = 16.00, P = 30.97). (Ans.a) ; (มีสารละลาย H3PO4
ความเข้มข้น 85.0% โดยมวล มีความหนาแน่น 1.70 g/mL ถ้าต้องการเตรียมสารละลาย H3PO4 ความเข้มข้น 2.00 M จำนวน 250.0 mL
จะต้องใช้สารละลายที่มีอยู่ก่อนจำนวนกี่กรัม)
รูปภาพที่เกี่ยวข้อง

Size : 86.63 KBs
Upload : 2013-08-05 14:28:31
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|