ปริมาณสารสัมพันธ์ ตอนที่ 4 ความเข้มข้นร้อยละ ppm เศษส่วนโมล
สารละลาย (Solution)
สารละลายเป็นสารเนื้อเดียวแต่ไม่ใช่สารบริสุทธิ์ มีสมบัติเป็นของผสมเนื้อเดียว โดยอัตราส่วนในการผสมเปลี่ยนแปลงได้ โดยสิ่งที่ผสมกันไม่ทำปฏิกิริยากัน
ฉะนั้นสารแต่ละชนิดที่ผสมกันอยู่ในสารละลายจึงยังคงมีสมบัติทางเคมีอย่างเดิม คือไม่มีสารใหม่เกิดขึ้น เป็นการเปลี่ยนแปลงทางกายภาพ (physical change)
แตกต่างจากการเปลี่ยนแปลงทางเคมี (chemical change) ที่มีสารใหม่เกิดขึ้น และอัตราส่วนโดยมวลหรือโดยจำนวนโมล ในการทำปฏิกิริยาคงที่
(กฎสัดส่วนคงที่) เช่น ก๊าซ H2 ติดไฟได้ ขณะที่ก๊าซ O2 ช่วยให้ไฟติด แต่เมื่อทำปฏิกิริยากันกลายเป็น H2O พบว่ามีสมบัติไม่เหมือนเดิมคือไม่ติดไฟ ไม่ช่วยให้ไฟติดแต่ใช้ดับไฟได้
(ชมแอนิเมชันแสดงการเปลี่ยนแปลงทางกายภาพและทางเคมี)
การจำแนกประเภทของสารเป็นดังนี้
สารละลายประกอบด้วยส่วนสำคัญ 2 ส่วนคือ ตัวทำละลาย (solvent) กับตัวละลาย (solute) สารละลายมีได้ทุกสถานะ สารละลายที่เป็นของแข็ง เช่น
โลหะผสมชนิดต่าง ๆ (ทองเหลือง นาก สำริด ทองเค)
(คลิ้ก ชมแอนิเมชัน solute & solvent)
การเปรียบเทียบทองเคกับเปอร์เซนต์ทองจะเปรียบเทียบได้ดังนี้
- ทอง 24เค เทียบเท่ากับ ทอง 100%
- ทอง 18เค เทียบเท่ากับ ทอง 75.00%
- ทอง 14เค เทียบเท่ากับ ทอง 58.33%
- ทอง 10เค เทียบเท่ากับ ทอง 41.67%
สารละลายที่เป็นของเหลว เป็นชนิดที่พบเห็น คุ้นเคยและเกี่ยวข้องกับชีวิตประจำวันเป็นอย่างมาก เช่น น้ำเกลือ น้ำหวาน น้ำปลา น้ำอัดลม... นอกจากนั้นยังมีสารละลายที่เป็นก๊าซ
เช่น อากาศ (อากาศเป็นได้ทั้งสารแขวนลอย คอลลอยด์และสารละลาย ขึ้นอยู่ที่ว่าจะพิจารณาที่องค์ประกอบส่วนใด) แต่ไม่ว่าจะเป็นสารละลายที่มีสถานะใดก็จะประกอบด้วยตัวทำละลาย
(solvemt) กับตัวละลาย (solute) เสมอ โดยทั่วไปให้ถือว่าสารที่มีมากที่สุดในสารละลายเป็นตัวทำละลาย บางครั้งจะพบว่าในตัวทำละลายเดียวกันอาจมีตัวละลายมากกว่า 1 ชนิดก็ได้
เช่น เติมน้ำตาลและเกลือลงไปในน้ำแก้วเดียวกัน สารละลายที่เกิดขึ้นก็จะมีทั้งน้ำตาลและเกลือเป็นตัวละลาย
ถ้าเราพิจารณาที่อัตราส่วนของตัวละลายกับตัวทำละลายที่มีอยู่ในสารละลายต่าง ๆ เราอาจจำแนกประเภทของสารละลายออกเป็น สารละลายเจือจาง (dilute solution)
คือมีอัตราส่วนของตัวละลายอยู่น้อย สารละลายเข้มข้น (concentration solution) คือมีอัตราส่วนของตัวละลายอยู่มากขึ้น สารละลายอิ่มตัว (saturated solution)
คือสารละลายที่มีตัวละลายมากจนละลายไม่หมด (แต่ไม่หยุดละลาย ยังคงละลายต่อไปแต่ขณะเดียวกันส่วนที่ละลายไปก่อนมีการตกผลึก จึงมีทั้งการละลายและการตกผลึกเกิดขึ้นพร้อมกัน
ถ้าสารละลายยังไม่อิ่มตัวจะไม่เกิดเหตุการณ์นี้) และสารละลายอิ่มตัวยิ่งยวด (super saturated solution)
สารละลายอิ่มตัวยิ่งยวดเกิดจากการนำสารละลายอิ่มตัวมาทำให้เกิดการละลายต่อไปอีก เช่น การละลายของโซเดียมอะซิเตต (CH3COONa) เราเตรียมสารละลายอิ่มตัวที่อุณหภูมิต่ำเอาไว้
จากนั้นเพิ่มอุณหภูมิให้แก่สารละลาย ทำให้ CH3COONa ละลายต่อไปได้อีกจนกระทั่งอิ่มตัวอีกครั้งหนึ่งที่อุณหภูมิสูง สารละลายอิ่มตัวที่เกิดขึ้นในครั้งหลังนี้เป็นสารละลายอิ่มตัวยิ่งยวด
ถ้าอุณหภูมิลดลงจะเกิดการตกผลึกทันที หรืออีกวิธีหนึ่งเตรียมสารละลาย CH3COONa อิ่มตัวเอาไว้ จากนั้นใส่ผลึก CH3COONa ลงไปอีกเล็กน้อยจะกลายเป็นสารละลายอิ่มตัวยิ่งยวด
แล้วตกผลึกทันทีเช่นกัน
(คลิ้ก ชมวีดีทัศน์แสดงการตกผลึกของสารละลายอิ่มตัวยิ่งยวด)
ความเข้มข้นของสารละลาย (Concentration)
หมายถึง การบอกปริมาณของตัวละลายที่มีอยู่ในสารละลายต่าง ๆ มีวิธีบอกความเข้มข้นของสารละลายได้หลายวิธี ดังนี้
1. ร้อยละ (percent)
1.1 ร้อยละโดยมวล/มวล หรือร้อยละโดยมวล (percent weight/weight , %w/w , % by w , percent by mass , %m/m , % by mass )
คือการบอกน้ำหนักของตัวละลาย ที่มีอยู่ในสารละลาย 100 หน่วยน้ำหนักที่เป็นหน่วยเดียวกัน เช่น C6H12O6 หนัก 10 กรัม ละลายในน้ำ 90 กรัม ได้สารละลายหนัก 100 กรัม
สารละลายจะมีความเข้มข้น ร้อยละ 10 โดยมวล หรือ 10% w/w หรือ 10% by mass …ดังรูป
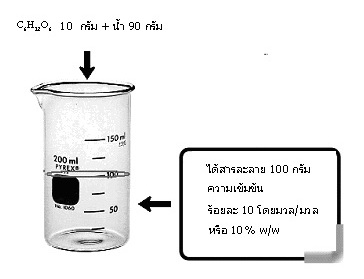
ถ้าทราบความหนาแน่นของสารละลายนี้จะช่วยให้คิดคำนวณเกี่ยวกับสารละลายนี้ได้เพิ่มขึ้น สมมติว่าสารละลายนี้มีความหนาแน่น 1.10 g/cm3 จงคำนวณหาสิ่งต่อไปนี้
ก. ถ้านำสารละลายนี้มา 50 cm3 จะมี C6H12O6 ละลายอยู่กี่กรัม
ข. ถ้าต้องการ C6H12O6 1 กรัม จะต้องนำสารละลายนี้มากี่ cm3
ค. ถ้านำสารละลายนี้มา 1 dm3 (1,000 cm3) จะมี C6H12O6 ละลายอยู่กี่โมล
วิธีทำ (ก) * สารละลายนี้มีความหนาแน่น 1.10 g/cm3
สารละลาย 1 cm3 หนัก 1.10 g
สารละลาย 50 cm3 หนัก 1.10 x 50 = 55.0 g
* สารละลายมีความเข้มข้น 10 % w/w
สารละลาย 100 g มี C6H12O6 ละลายอยู่ 10 g
สารละลาย 55 g มี C6H12O6 ละลายอยู่ = 5.50 g ตอบ
(ข) * สารละลายมีความเข้มข้น 10 % w/w
ถ้าต้องการ C6H12O6 10 กรัม ต้องนำสารละลายมา 100 กรัม
ถ้าต้องการ C6H12O6 1 กรัม ต้องนำสารละลายมา = 10 กรัม
* สารละลายนี้มีความหนาแน่น 1.10 g/cm3
สารละลาย 1.10 กรัม มีปริมาตร 1 cm3
สารละลาย 10 กรัม มีปริมาตร = 9.09 cm3 ตอบ
(ค) * สารละลายนี้มีความหนาแน่น 1.10 g/cm3
สารละลาย 1 cm3 หนัก 1.10 g
สารละลาย 1,000 cm3 หนัก = 1,100 g
* สารละลายมีความเข้มข้น 10 % w/w
สารละลาย 100 g มี C6H12O6 ละลายอยู่ 10 g
สารละลาย 1,100 g มี C6H12O6 ละลายอยู่ = 110 g
คิดเป็นจำนวนโมล ; n = W/M
n = 110/C6H12O6 = 110/180 = 0.61 โมล ตอบ
1.2 ร้อยละโดยมวล/ปริมาตร (percent weight/volume , %w/v) คือการบอกน้ำหนักของตัวละลาย ที่มีอยู่ในสารละลาย 100 หน่วยปริมาตร
โดยกำหนดให้ใช้หน่วยของมวลกับปริมาตรที่สัมพันธ์กัน คือ กรัม (g) ใช้กับลูกบาศก์เซนติเมตร (cm3) หรือ กิโลกรัม (kg) ใช้กับลิตร (l) หรือลูกบาศก์เดซิเมตร (dm3)
เช่น C6H12O6 หนัก 10 กรัม ละลายน้ำจนได้สารละลาย 100 cm3 สารละลายจะมีความเข้มข้น ร้อยละ 10 โดยมวล/ปริมาตร หรือ 10 % w/v ดังรูป

ถ้าทราบความหนาแน่นของสารละลายนี้จะช่วยให้คิดคำนวณเกี่ยวกับสารละลายนี้ได้เพิ่มขึ้น สมมติว่าสารละลายนี้มีความหนาแน่น 1.10 g/cm3 จงคำนวณหาสิ่งต่อไปนี้
ก. ถ้านำสารละลายนี้มา 50 cm3 จะมี C6H12O6 ละลายอยู่กี่กรัม
ข. ถ้าต้องการ C6H12O6 1 กรัม จะต้องนำสารละลายนี้มากี่กรัม
ค. ถ้านำสารละลายนี้มา 1 dm3 (1,000 cm3) จะมี C6H12O6 ละลายอยู่กี่โมล
วิธีทำ (ก)
* สารละลายมีความเข้มข้น 10 % w/v
สารละลาย 100 g มี C6H12O6 ละลายอยู่ 10 g
สารละลาย 50 g มี C6H12O6 ละลายอยู่ = 5.00 g ตอบ
(ข) * สารละลายมีความเข้มข้น 10 % w/w
ถ้าต้องการ C6H12O6 10 กรัม ต้องนำสารละลายมา 100 cm3
ถ้าต้องการ C6H12O6 1 กรัม ต้องนำสารละลายมา = 10 cm3
* สารละลายนี้มีความหนาแน่น 1.10 g/cm3
สารละลาย 1 cm3 มีน้ำหนัก 1.10 กรัม
สารละลาย 10 cm3 มีน้ำหนัก 1.10 x 10 = 11.00 กรัม ตอบ
(ค) * สารละลายมีความเข้มข้น 10 % w/v
สารละลาย 100 cm3 มี C6H12O6 ละลายอยู่ 10 g
สารละลาย 1,100 cm3 มี C6H12O6 ละลายอยู่ = 110 g
คิดเป็นจำนวนโมล ; n = W/M
n = 110/C6H12O6 = 110/180 = 0.61 โมล ตอบ
1.3 ร้อยละโดยปริมาตร/ปริมาตร (percent volume/volume , %v/v) คือการบอกปริมาตรของตัวละลายที่มีอยู่ในสารละลาย 100 หน่วยปริมาตร
โดยเป็นหน่วยปริมาตรหน่วยเดียวกัน เช่น เอทานอล (C2H6O) 10 cm3 + น้ำ 90 cm3 กลายเป็นสารละลาย 100 cm3 สารละลายนี้มีความเข้มข้นร้อยละ 10 โดยปริมาตร/ปริมาตร
หรือ 10 % v/v ดังรูป

ถ้าทราบความหนาแน่นของสารละลายนี้จะช่วยให้คิดคำนวณเกี่ยวกับสารละลายนี้ได้เพิ่มขึ้น สมมติว่าสารละลายนี้มีความหนาแน่น 1.10 g/cm3 จงคำนวณหาสิ่งต่อไปนี้
ก. ถ้านำสารละลายนี้มา 50 cm3 จะมี C2H6O ละลายอยู่กี่กรัม (ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3)
ข. ถ้าต้องการ C2H6O 1 กรัม จะต้องนำสารละลายนี้มากี่กรัม(ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3)
ค. ถ้านำสารละลายนี้มา 1 dm3 (1,000 cm3) จะมี C2H6O ละลายอยู่กี่โมล(ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3)
วิธีทำ (ก)
* สารละลายมีความเข้มข้น 10 % v/v
สารละลาย 100 cm3มี C2H6O ละลายอยู่ 10 cm3
สารละลาย 50 cm3 มี C2H6O 6 ละลายอยู่ = 5.00 cm3
*ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3
C2H6O 1 cm3 หนัก = 0.8 g
C2H6O 5 cm3 หนัก = 0.8 x 5 g
= 4.0 g ตอบ
(ข) * ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3
C2H6O หนัก 0.8 g มีปริมาตร = 1.0 cm3
C2H6O หนัก 1.0 g มีปริมาตร = 1.0/0.8 = 1.25 cm3
สารละลายมีความเข้มข้น 10 % v/v
ถ้าต้องการ C2H6O 10 cm3 ต้องนำสารละลายมา 100 cm3
ถ้าต้องการ C2H6O 1.25 cm3 ต้องนำสารละลายมา = 12.5 cm3
* สารละลายนี้มีความหนาแน่น 1.10 g/cm3
สารละลาย 1 cm3 มีน้ำหนัก 1.10 กรัม
สารละลาย 12.5 cm3 มีน้ำหนัก 12.5 x 10 = 125 กรัม ตอบ
(ค) * สารละลายมีความเข้มข้น 10 % v/v
สารละลาย 100 cm3 มี C2H6O ละลายอยู่ 10 cm3
สารละลาย 1,000 cm3 มี C2H6O ละลายอยู่ = 100 cm3
* ความหนาแน่นของ C2H6O บริสุทธิ์ = 0.8 g/cm3
ฉะนั้น C2H6O จำนวน 100 cm3 หนัก = 100 x 0.8 = 80 g
คิดเป็นจำนวนโมล ; n = W/M
n = 80/C2H6O = 80/46 = 1.74 โมล ตอบ
แบบฝึกหัด
1. น้ำกลั่น 0.10 kg มีน้ำตาลกลูโคส (C6H12O6) ละลายอยู่ 13.50 กรัม สารละลายจะมีความเข้มข้นคิดเป็นร้อยละโดยมวลเท่าไร (ตอบ 11.90)
2. น้ำยาฟอกขาวชนิดหนึ่งมีความเข้มข้นของโซเดียมไฮโปคลอไรต์ (NaOCl) ร้อยละ 3.62 โดยมวล ถ้าชนิดบรรจุขวดมีน้ำหนัก 2,500 กรัม จะมี NaOCl ละลายอยู่กี่กรัม
(ตอบ 90.50 กรัม)
3. แคลเซียมคลอไรด์ (CaCl2) 16.50 กรัม ละลายอยู่ในน้ำ 450 กรัม สารละลายมีความเข้มข้นร้อยละโดยมวลเท่าไร
4. ไอโอดีน (I2) จำนวน 0.065 โมล ละลายอยู่ใน CCl4 หนัก 120 กรัมอยากทราบว่าความเข้มข้นของสารละลาย คิดเป็นร้อยละเท่าไรโดยมวล (I = 127)
5. โซดาซักผ้า (Na2CO3) หนัก 18.00 กรัม นำไปละลายน้ำจนได้สารละลาย 85 cm3 สารละลายจะมีความเข้มข้นเท่าไรเมื่อคิดเป็นร้อยละโดยมวล/ปริมาตร
(Na=23 O=16 C=12)
6. น้ำกลั่น 85.00 กรัม เติมโซดาซักผ้าลงไป 18.00 กรัม คนจนละลายหมด สารละลายที่ได้จะมีความเข้มข้นเท่าไรเมื่อคิดเป็นร้อยละโดยมวล/มวล
7. ถ้ามีโซดาซักผ้าอยู่ 5.75 กรัม จะทำให้เป็นสารละลายที่มีความเข้มข้นร้อยละ 0.75 โดยมวล/ปริมาตร จะเตรียมสารละลายดังกล่าวได้อย่างมากที่สุดกี่ cm3
8. แอมโมเนียมไฮโดรเจนคาร์บอเนต (NH4HCO3) หนัก 1.00 กรัม ทำให้เป็นสารละลาย 25.00 กรัม อยาก ทราบว่า สารละลายมีความเข้มข้นเท่าไร
เมื่อคิดเป็นร้อยละโดยมวล/มวล
9. น้ำโซดา คือสารละลายอิ่มตัวของกรดคาร์บอนิก (H2CO3) ชนิดบรรจุขวดขนาดเล็กมีปริมาตร 325 cm3 มีความหนาแน่น 1.05 g/cm3 ถ้าน้ำบริสุทธิ์มีความหนาแน่น
1.00 g/cm3 อยากทราบว่า (ให้คิดว่าการที่มี H2CO3 ละลายน้ำ ไม่ทำให้ปริมาตรของน้ำเปลี่ยนแปลง)
9.1 น้ำโซดา 1 ขวด มี H2CO3 ละลายอยู่กี่กรัม
9.2 ความเข้มข้นของสารละลายเป็นเท่าไร เมื่อคิดเป็นร้อยละโดยมวล/ปริมาตร
9.3 ความเข้มข้นของสารละลายเป็นเท่าไร เมื่อคิดเป็นร้อยละโดยมวล/มวล
10. ฉลากข้างขวดของน้ำหวาน Hale’s แนะนำว่าให้ผสมน้ำหวาน 1 ส่วนต่อน้ำ 4 ส่วน จะได้น้ำหวานพร้อมดื่มที่มีความเข้มข้นของน้ำตาล 13.00 % (โดยมวล/ปริมาตร)
อยากทราบว่าน้ำหวานที่ยังไม่ได้ผสมน้ำจะมีความเข้มข้นเท่าไรในหน่วยเดียวกัน
11. สุรา 35 ดีกรี เกิดจากการผสมเอทิลแอลกอฮอล์ (C2H5OH หรือ C2H6O) บริสุทธิ์ 35.00 cm3 กับน้ำกลั่น 65.00 cm3 นักดื่มสุราจะนำมาผสมกับน้ำโซดาแล้วดื่ม
ถ้าโดยเฉลี่ยแล้วการดื่มสุราชนิด 35 ดีกรี 1 ขวด ซึ่งมีปริมาตร 700 cm3 จะผสมกับน้ำโซดาขวดเล็ก , 325 cm3 จำนวน 15 ขวด อยากทราบว่าเมื่อคิดโดยเฉลี่ยแล้ว
สุราที่ดื่มจะมีความเข้มข้นเท่าไรเมื่อคิดเป็นร้อยละโดยปริมาตร/ปริมาตร
12. แคลเซียมซัลเฟต (CaSO4) หนัก 15.00 กรัม ละลายน้ำจนเกิดสารละลาย 240.00 cm3 ถ้าสารละลายนี้มีความหนาแน่น 1.005 g/cm3 อยากทราบว่า (Ca=40 S=32 O=16)
12.1 สารละลายมีความเข้มข้นเท่าไรเมื่อคิดเป็นร้อยละโดยมวล/ปริมาตร
12.2 สารละลายมีความเข้มข้นเท่าไรเมื่อคิดเป็นร้อยละโดยมวล/มวล
12.3 ถ้าดื่มสารละลายนี้ 10.00 cm3 ร่างกายจะได้รับ Ca2+ จำนวนกี่ไอออน
13. แร่แบไรต์ (Barite , BaSO4) หนัก 0.75 กรัม เมื่อนำไปละลายน้ำจะแตกตัวเป็น Ba2+ กับ SO42- ถ้าสารละลายที่ได้มีปริมาตร 78.00 cm3 มีความหนาแน่น 1.025 g/cm3
อยากทราบว่า (Ba=137)
17.1 ความเข้มข้นของสารละลาย BaSO4 เป็นเท่าไร เมื่อคิดเป็นร้อยละโดยมวล/มวล
17.2 ความเข้มข้นของสารละลาย BaSO4 เป็นเท่าไร เมื่อคิดเป็นร้อยละโดยมวล/ปริมาตร
14. น้ำบริสุทธิ์ปริมาตร 105 cm3 ที่ 4 oC ซึ่งทำให้อิ่มตัว ด้วยก๊าซ NH3 จะให้สารละลาย ที่มีความหนาแน่น 0.9 g/cm3 และมีความเข้มข้นของ NH3 = 30 % โดยมวล/มวล
จงคำนวณหาปริมาตรของสารละลาย NH3 ที่ได้( ความหนาแน่นของน้ำ = 1 g/cm3 ) (ENT’36)
1. 150 2. 166.67 3. 147 4. 197
15. สารละลายชนิดหนึ่งเกิดจาก NaOH 8.00 g. ละลายน้ำ 70.0 g. อยากทราบว่ามีความเข้มข้นร้อยละเท่าไรโดยมวล/มวล และถ้าสารละลายนี้มีความหนาแน่น 1.20 g/cm3
จะมีความเข้มข้นร้อยละเท่าไรโดยมวล/ปริมาตร (ตอบ 10.3 และ 12.3)
16. นำ C2H5OH ปริมาตร 50.0 cm3 ผสมกับน้ำจนได้สารละลาย 96.54 cm3 จงคำนวณหาความเข้มข้นของสารละลายนี้ว่าเป็นร้อยละเท่าไรโดยปริมาตร/ปริมาตร (ตอบ 51.8)
17. จงคำนวณหาน้ำหนัก H2SO4 ซึ่งละลายอยู่ในสารละลายที่มีความเข้มข้น 15% โดยมวล จำนวน 25 g
18. สารละลายกรด HCl มีความหนาแน่น 1.19 g/cm3 และมีความเข้มข้นของ HCl 37.2 % โดยมวล จงคำนวณหาว่าถ้านำสารละลายนี้มา 1.00 dm3 จะมี HCl ละลายอยู่กี่กรัม
(ตอบ 443 g)
19. จงหาปริมาตรของสารละลาย Fe(NO3)3 เข้มข้นร้อยละ 15 โดยมวล ซึ่งมี Fe(NO3)3 ละลายอยู่ 30 g สารละลายมีความหนาแน่น 1.16 g/cm3 (Fe=56 N=14 O=16)
20. สารละลาย H2SO4 เข้มข้นร้อยละ 35 โดยมวล ความหนาแน่น 1.26 g/cm3 อยากทราบว่าในสารละลายนี้ 100 cm3 จะมี H2SO4 อยู่กี่กรัม
21. ต้องชั่งสารละลาย NaCl เข้มข้น 5.0 % โดยมวล กี่กรัม จึงจะได้ NaCl จำนวน 3.2 กรัม อยู่ในสารละลายนี้ (ตอบ 64 กรัม)
22. สารละลาย H2SO4 เข้มข้น 98 %โดยมวล มีความหนาแน่น 1.86 g/cm3 ปริมาตรของสารละลายนี้เป็นเท่าใด จึงจะมี H2SO4 ละลายอยู่อยู่ 40.0 กรัม ( ตอบ 22.2 cm3 )
23. สารละลายกรดไฮโดรคลอริก ความเข้มข้น 37.23 % โดยมวล มีความหนาแน่น 1.19 g/cm3 จงคำนวณหาน้ำหนักของกรดไฮโดรคลอริกในสารละลายนี้ที่มีปริมาตร 5.00 cm3
( ตอบ 2.22 g )
2. ส่วนในล้านส่วน (part per million , ppm)
เป็นการบอกน้ำหนักของตัวละลายที่มีอยู่ในสารละลาย 1 ล้านหน่วยน้ำหนักที่เป็นหน่วยเดียวกัน เป็นลักษณะเดียวกับร้อยละโดยมวลแต่มีความละเอียดมากกว่า
นอกจากนั้นยังมีหน่วยความเข้มข้นในทำนองเดียวกันนี้ เช่น part per billion หรือ ppb (ส่วนในพันล้านส่วน) เช่น สารตะกั่ว 10 มิลลิกรัม ละลายในน้ำ 999,990 มิลลิกรัม
กลายเป็นสารละลาย 100,000 มิลลิกรัม สารละลายนี้มีความเข้มข้นของตะกั่ว 10 ppm

3. เศษส่วนโมล (mole fraction)
เป็นการบอกความเข้มข้นด้วยอัตราส่วนจำนวนโมลของตัวละลาย/จำนวนโมลทั้งหมดในสารละลาย เช่น ถ้าเรานำ C6H12O6 จำนวน 18.0 กรัม
NaCl 11.7 กรัม และน้ำ 180.0 กรัม ละลายรวมกัน
ดังรูป

การหาเศษส่วนโมลต้องเริ่มจากการหาจำนวนโมลของสารทุกชนิดที่มีอยู่ในสารละลาย ทั้งจำนวนโมล ของตัวละลายและจำนวนโมลของตัวทำละลาย จากตัวอย่างในรูป
- จำนวนโมลของ H2O = = 18.00 โมล
- จำนวนโมลของ NaCl = = 0.20 โมล
- จำนวนโมลของ C6H12O6 = 18/180 = 0.10 โมล
ขั้นต่อไปให้นำจำนวนโมลของสารทุกชนิดมารวมกัน
จากตัวอย่างนี้จำนวนโมลรวม = 18.0 + 0.20 +0.10 = 18.30 โมล
ขั้นต่อไปหาเศษส่วนโมลของแต่ละสารจากสมการ ;
เศษส่วนโมลของสาร = จำนวนโมลของสาร/จำนวนโมลรวม
- เศษส่วนโมลของ H2O = 18/18.30 = 0.98
- เศษส่วนโมลของ NaCl = 0.20/18.30 = 0.012
- เศาส่วนโมลของ C6H12O6 = 0.10/18.30 = 0.0055
* เมื่อนำเศษส่วนโมลของทุกสารมารวมกันจะมีค่า = 1.00
แบบฝึกหัด
1. ดินปืนหนัก 2.50 กรัม พบว่ามี Zn2+ เป็นส่วนประกอบอยู่ 5.4 ความเข้มข้นของ Zn2+ เป็นกี่ ppm (กำหนดให้ 1 = 10-6 g) (ตอบ 2.20 ppm)
2. แร่เงิน 1.00 ตัน มีโลหะเงินเป็นส่วนประกอบอยู่ 83.50 กรัม อยากทราบว่าส่วนประกอบของโลหะเงินคิดเป็นกี่ ppm
3. น้ำทะเล 1.00 กิโลกรัม มี Ca2+ ละลายอยู่ 0.412 กรัม ความเข้มข้นของ Ca2+ เป็นกี่ ppm
4. จงหาเศษส่วนโมล (mole fraction) ของสารละลายต่อไปนี้
4.1 CH3OH 8.50 กรัม ในน้ำ 224.00 กรัม
4.2 CH3OH 65.20 กรัม ใน CCl4 144.00 กรัม
4.3 phenol , C6H5OH 4.50 กรัม ในน้ำ 855.00 กรัม
4.4 phenol , C6H5OH 44.00 กรัม ในเอทิลแอลกอฮอล์ , CH3CH2OH 550 กรัม
5. แอมโมเนียมไฮโดรเจนคาร์บอเนต (NH4HCO3) หนัก 1.00 กรัม ทำให้เป็นสารละลาย 25.00 กรัม อยากทราบว่าสารละลายมีความเข้มข้นเท่าไรเมื่อคิดเป็น ppm
6. น้ำโซดา คือสารละลายอิ่มตัวของกรดคาร์บอนิก (H2CO3) ชนิดบรรจุขวดขนาดเล็กมีปริมาตร 325 cm3 มีความหนาแน่น 1.05 g/cm3 ถ้าน้ำบริสุทธิ์มีความหนาแน่น 1.00 g/cm3
อยากทราบว่าความเข้มข้นของสารละลายเป็นเท่าไร เมื่อคิดเป็น ppm
7. แร่แบไรต์ (Barite , BaSO4) หนัก 0.75 กรัม เมื่อนำไปละลายน้ำจะแตกตัวเป็น Ba2+ กับ SO42- ถ้าสารละลายที่ได้มีปริมาตร 78.00 cm3 มีความหนาแน่น 1.025 g/cm3
อยากทราบว่า ความเข้มข้นของ Ba2+ ในสารละลายเป็นกี่ ppm (Ba=137)
8. น้ำกระด้างตัวอย่างมี SO42- และ HCO3- 96 และ 183 ppm ตามลำดับโดยมีไอออนบวกเป็น Ca2+ เท่านั้น ปริมาณของ Ca2+ ในหน่วย ppm มีค่าเท่าใด
( S = 32 , H = 1 , C = 12 , O = 16 )
1. 100 2. 160 3. 188 4. 279
9. เมื่อนำเนื้อปลาชนิดหนึ่งหนัก 100 กรัม มาวิเคราะห์พบว่ามีปรอท 0.2 ส่วนในล้านส่วนโดยน้ำหนัก เนื้อปลานี้ มีปรอทอยู่กี่อะตอม (Hg = 200.6)
1. 2.0 x 10-5 2. 6.0 x 1013 3. 2.0 x 1016 4. 6.0 x 1016
10. What is the mole fraction of CH3CH2CH2OH in a solution prepared from 0.932 moles of CH3CH2CH2OH and 2.44 moles of water? (Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.e) ; (สารละลายที่ประกอบด้วย CH3CH2CH2OH 0.932 โมล กับน้ำ 2.44 โมล
เศษส่วนโมลของ CH3CH2CH2OH เป็นเท่าไร)
a) 0.241 b) 0.227 c) 0.258 d) 0.292 e) 0.276
11. What is the mole fraction of CH3CH2OH in a solution prepared from 1.56 moles of CH3CH2OH and 1.55 moles of water?
(Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.e); (สารละลายที่ประกอบด้วย CH3CH2OH 1.56 โมล กับน้ำ 1.55 โมล
เศษส่วนโมลของ CH3CH2OH เป็นเท่าไร)
a) 0.460 b) 0.443 c) 0.412 d) 0.482 e) 0.502
12. What is the mole fraction of CsCl in a solution prepared from 0.297 moles of CsCl and 2.78 moles of water?
(Atomic weights: Cs = 132.9, Cl = 35.45, H = 1.008, O = 16.00). (Ans.e); (สารละลายที่ประกอบด้วย CsCl 0.297 โมล กับน้ำ 2.78 โมล
เศษส่วนโมลของ CsCl เป็นเท่าไร)
a) 0.116 b) 0.0861 c) &nb
รูปภาพที่เกี่ยวข้อง

Size : 140.57 KBs
Upload : 2013-08-03 06:24:42
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|