กรด - เบส ตอนที่ 3 การแตกตัวของน้ำบริสุทธิ์และ pH ของสารละลาย
กรด – เบส
ตอนที่ 3
การแตกตัวของน้ำบริสุทธิ์และ pH ของสารละลาย
การแตกตัวของน้ำบริสุทธิ์
ตามที่เคยทราบว่าน้ำบริสุทธิ์มีสมบัติเป็นกลาง (neutral) คือไม่เป็นกรดไม่เป็นเบสนั้น มาถึงขั้นนี้ต้องทำความเข้าใจเพิ่มเติมว่าน้ำบริสุทธิ์ยังมีความเป็นกลางอยู่ แต่โมเลกุลของน้ำจะเป็นได้ทั้งกรดและเบสตามทฤษีของบรอนสเต็ตและเลาว์รี และทฤษฎีของลิวอิส ดังรูป
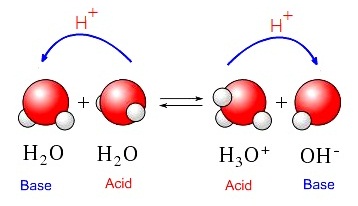
(คลิ้ก ชมโมเลกุลของน้ำบริสุทธิ์)
(คลิ้ก ชมวีดีทัศน์แสดงการแตกตัวของน้ำ)
การแตกตัวของน้ำบริสุทธิ์เป็นปฏิกิริยาที่ผันกลับได้จึงมีภาวะสมดุลเกิดขึ้น ดังสมการ
H2O
+ H2O ↔ H3O+ + OH-
2H2O
↔ H3O+ + OH-
ค่าคงที่สมดุล ( K ) เป็นดังนี้
;

K[H2O]2 = [H3O+] [OH-]
กำหนดให้เรียก K[H2O]2 ว่า ค่าคงที่สมดุลของน้ำบริสุทธิ์ ใช้สัญลักษณ์ว่า Kw ฉะนั้น
Kw =
[H3O+] [OH-]
จากสมการจะเห็นว่า [H3O+] = [OH- ] ฉะนั้น Kw
= [H3O+]2 =
[OH- ]2
ค่า Kw
เป็นค่าคงที่ = 1.0 x 10-14 (mol/dm3)2 ณ
อุณหภูมิ 25 oC
เมื่อแทนค่า Kw ลงไปในสมการจะเป็นดังนี้ ; 1.0 x 10-14 = [H3O+]2 =
[OH-]2
ถอดรากที่ 2 จะเป็นดังนี้ 1.0 x 10-7 = [H3O+] = [OH-]
ดังที่ทราบมาในตอนต้นแล้วว่า H3O+ ทำให้สารละลายเป็นกรด ในขณะที่ OH- ทำให้สารละลายเป็นเบส แต่ในน้ำบริสุทธิ์มี [H3O+] = [OH- ]
ฉะนั้นน้ำบริสุทธิ์จึงเป็นกลาง (Neutral)
จากสมการ [H3O+]
= [OH- ] = 1.0
x 10-7
ความเป็นกรดน้ำ แสดงด้วยค่า Ka ดังนี้
 ความเป็นเบสของน้ำ แสดงด้วยค่า Kb ดังนี้ ความเป็นเบสของน้ำ แสดงด้วยค่า Kb ดังนี้
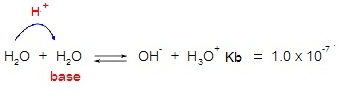
** ผลคูณระหว่าง Ka.Kb = (1.0 x 10-7)(1.0
x 10-7)
= 1.0 x 10-14 (ค่านี้คือค่า Kw)
ฉะนั้นจึงแสดงในรูปสมการได้ว่า ; Ka.Kb =
Kw สมการนี้มีความสำคัญซึ่งจะต้องใช้มากในเรื่องกรดอ่อนและเบสอ่อน
ระดับความเป็นกรด-เบส (pH)
น้ำบริสุทธิ์เป็นระบบที่มีภาวะสมดุล ดังสมการ 2H2O
↔ H3O+ + OH- ในขณะที่เป็นน้ำบริสุทธิ์ [H3O+] =
[OH- ] น้ำบริสุทธิ์จึงเป็นกลาง (neutral) แต่น้ำเป็นตัวทำละลายที่ดี จึงมีสารต่าง ๆ ละลายอยู่ในน้ำได้มากมายทำให้น้ำบริสุทธิ์กลายเป็นสารละลาย
สารบางชนิดแม้จะละลายอยู่ในน้ำแต่ไม่ได้รวบกวนภาวะสมดุลของน้ำ ฉะนั้นในสารละลายจึงมี [H3O+] = [OH- ] เสมือนหนึ่งเป็นน้ำบริสุทธิ์ สารละลายประเภทนี้จึงเป็นกลาง เช่นสารละลายน้ำตาลทราย สารละลายเกลือแกง
ในขณะเดียวกันมีสารอีกเป็นจำนวนมากที่ละลายน้ำแล้วมีการรบกวนภาวะสมดุลของน้ำ ซึ่งมีความเป็นไปได้ 2 แบบ
คือ
สารบางชนิดเมื่อละลายน้ำแล้วจะไปเพิ่ม [H3O+]
หรือ [H+]
ทำให้ [H3O+] > [OH- ] กลายเป็นสารละลายกรด แต่สารบางชนิดเมื่อละลายน้ำแล้วจะไปเพิ่ม [OH-
] ทำให้ [OH-
] > [H3O+] กลายเป็นสารละลายเบส
ให้คิดเอาไว้เสมอว่าไม่ว่าจะเป็นสารละลายกรดหรือสารละลายเบส ในสารละลายก็จะมีทั้ง H3O+ และ
OH-
ละลายอยู่ทั้ง 2 ชนิด และ
[H3O+][OH- ] =
Kw
ความเป็นกรดหรือเบสมีได้หลายระดับ เรียกว่า pH กำหนดให้คิดจากค่า -log[H3O+] หรือ -log[H+] ที่มีอยู่ในสารละลายนั้น
ๆ ดังสมการ
pH
= -log[H3O+] หรือ -log[H+]
pH ของน้ำกลั่น = -log[H3O+]
= -log 1.0 x 10-7
= 7 log 10 – log 1
= 7
ถ้าคิดค่า -log[OH-] ค่าที่ได้จะเรียกว่า pOH ดังสมการ
pOH ของน้ำกลั่น = -log[OH-]
= -log 1.0 x 10-7
= 7 log 10 – log 1
= 7
ถ้านำค่า pH รวมกับ pOH จะได้
= 14 ดังสมการ
pH + pOH
= 14
pH =
14 – pOH
การคิดค่า pH ของสารละลายกรดแก่ เบสแก่
กรดอ่อนและเบสอ่อน
ศึกษาจากตัวอย่างต่อไปนี้
ตัวอย่างต่อไปนี้แสดงการหา pH ของสารละลายกรดแก่ เบสแก่
กรดอ่อนและเบสอ่อน
ซึ่งแต่ละชนิดมีความเข้มข้น 1 mol/dm3 เท่ากัน
1. pH ของสารละลายกรดแก่
สารละลายกรดแก่ HCl ความเข้มข้น
1.00 mol/dm3 มี pH เท่าไร
วิธีคิด กรด HCl เป็นกรดแก่ จึงแตกตัว 100% ดังสมการ
HCl + H2O → H3O+ + Cl-
เริ่มต้น 1 mol/dm3 - -
สิ้นสุด - 1 mol/dm3
pH =
-log[H3O+]
= -log 1
= 0 ตอบ
2.
pH
ของสารละลายเบสแก่
สารละลายเบสแก่ NaOH ความเข้มข้น
1.00 mol/dm3 มี pH เท่าไร
วิธีคิด เบส NaOH เป็นเบสแก่
จึงแตกตัว 100% ดังสมการ
NaOH → Na+ + OH-
เริ่มต้น 1 mol/dm3 - -
สิ้นสุด - 1 mol/dm3
การหาค่า pH ของสารละลายเบสทำได้ 2 วิธี
คือ หาค่า pOH โดยตรงจาก –log[OH-] แล้วเปลี่ยนเป็น pH จากสมการ
pH = 14
- pOH ดังตัวอย่าง
pOH =
–log[OH-]
= –log[1]
= 0
pH =
14 - pOH
= 14
- 0
= 14 ตอบ
อีกวิธีหนึ่งคือเมื่อทราบ
[OH-] นำไปหาค่า [H3O+] แล้วจึงหาค่า pH ดังตัวอย่าง
[H3O+] [OH-] =
Kw
[H3O+] = Kw /[OH-] = (1.0 x 10-14) / 1 = 1.0 x 10-14
pH =
-log[H3O+]
=
-log1.0 x 10-14
= 14log10
- log 1
= 14 ตอบ
3.
pH
ของสารละลายกรดอ่อน
การหา pH
ของสารละลายกรดอ่อนต้องทราบความเข้มข้นของสารละลายและค่า Ka ของกรดอ่อนนั้นด้วย เช่น
สารละลายกรดอ่อน HA ความเข้มข้น 1.00 mol/dm3 มีค่า Ka
= 1.0 x 10-4 สารละลายมี pH เท่าไร
วิธีคิด
HA
+ H2O ↔ H3O+ + A- ; Ka = 1.0 x 10-4
เริ่มต้น 1.00 mol/dm3 - -
เปลี่ยนแปลง
x mol/dm3 x
mol/dm3 x mol/dm3
สมดุล
1.0-x mol/dm3 x mol/dm3 x
mol/dm3
Ka = [H3O+][A-] / [HA]
1.0
x 10-4 = [H3O+]2 / 1
1.0
x 10-4 = [H3O+]2
[H3O+] = 1.0
x 10-2 mol/dm3
pH = -log[H3O+]
= -log 1.0 x 10-2
= 2 ตอบ
4.
pH
ของสารละลายเบสอ่อน
การหา pH
ของสารละลายเบสอ่อนต้องทราบความเข้มข้นของสารละลายและค่า Kb ของเบสอ่อนนั้นด้วย เช่น
สารละลายเบสอ่อน BOH ความเข้มข้น 1.00 mol/dm3 มีค่า Kb
= 1.0 x 10-4 สารละลายมี pH เท่าไร
การหาค่า pH ของสารละลายเบสอ่อนทำได้ 2 แบบ
ทำนองเดียวกับเบสแก่ คือ หา
pOH เมื่อทราบ
[OH-]
แล้วจึงเปลี่ยนเป็น pH จากสมการ pH
= 14 – pOH หรือจะใช้วิธีเปลี่ยน [OH-] ให้เป็น [H3O+] เสียก่อนแล้วจึงหา pH ก็ได้
วิธีคิด วิธีที่ 1 หา [OH-] แล้วหา pOH แล้วเปลี่ยนเป็น pH
BOH ↔ B+ + OH- ; Kb
= 1.0 x 10-4
เริ่มต้น 1.00 mol/dm3 - -
เปลี่ยนแปลง x mol/dm3 x
mol/dm3 x mol/dm3
สมดุล 1.0-x mol/dm3 x mol/dm3 x mol/dm3
Kb = [B+][OH-]
1.0 x 10-4 = [x]2
[x] = 1.0
x 10-2
[OH-] = 1.0
x 10-2 mol/dm3
pOH = -log[OH-]
= -log 1.0 x 10-2
= 2
pH = 14-pOH
= 14 - 2
= 12 ตอบ
วิธีที่ 2 หา [OH-] แล้วเปลี่ยนเป็น [H3O+] แล้วหา pH
BOH ↔ B+ + OH- ; Kb
= 1.0 x 10-4
เริ่มต้น 1.00 mol/dm3 - -
เปลี่ยนแปลง x mol/dm3 x
mol/dm3 x mol/dm3
สมดุล
1.0-x mol/dm3 x mol/dm3 x mol/dm3
Kb = [B+][OH-]
1.0 x 10-4 = [x] [x]
1.0 x 10-4 = [x]2
[x] = 1.0
x 10-2
[OH-] = 1.0
x 10-2 mol/dm3
จากสมการ [H3O+] = Kw / [OH-] = 1.0 x 10-14 / 1.0 x 10-2
= 1.0 x 10-12 mol/dm3
pH =
-log[H3O+]
= -log
1.0 x 10-12
= 12 ตอบ
(คลิ้ก
ทดลองเสมือนจริงและการคำนวณค่า pH)
(คลิ๊ก ชม pH scale )
แบบฝึกหัด
Basic rule
The pH of a solution indicates how acidic or basic
that solution is.
pH range of
0-7 acidic
7 neutral
7-14 basic
Since [H+]·[OH-] = 10-14
at 25°C, if [H+]
is known, the [OH-] can be calculated and vice versa.
pH = -log
[H+] So if [H+]
= 10-6 M, pH = 6
pOH = -log
[OH-] So if [OH-]
= 10-8, pOH = 8
Together, pH + pOH = 14.
1.
What is the
pH of a 0.400 M ammonia solution? (Kb = 1.8 x 10-5) Write the reaction for the
dissociation of
ammonia in water. Water is part of the reaction. (สารละลายแอมโมเนียความเข้มข้น 0.400 M มี pH เท่าไร
จง
เขียนสมการแสดงการแตกตัวของน้ำ โดยให้น้ำเป็นส่วนหนึ่งของปฏิกิริยาด้วย)
2. If the pH
of a solution of calcium hydroxide is 9.5, what is the concentration of the solution?
(ถ้าสารละลายแคลเซียมไฮดรอกไซด์มีค่า pH 9.5
อยากทราบว่าสารละลายดังกล่าวมีความเข้มข้นเท่าไร)
3.
The pH of an ammonia solution is 9.5. What is the concentration of the solution? Kb=1.8x10-5
(ถ้าสารละลายแอมโมเนียมี pH 9.5 อยากทราบว่ามีความเข้มข้นเท่าไร)
4. What is
the pH of an NaOH solution that is 0.25 Molar?
(สารละลาย NaOH ความเข้มข้น 0.25 Molar มี pH เท่าไร)
5. What is the molarity of a hydrochloric acid
solution that has 12.5g dissolved in 2.0 liters. What is the pH of the
solution? Write the dissociation for the dissolving of
the acid.
(เมื่อใช้กรดไฮโดรคลอริก
12.5g
ทำให้เป็นสารละลาย 2.0
ลิตร อยากทราบว่าสารละลายจะมี pH เท่าไร
จงเขียน
สมการแสดงการแตกตัวของกรดด้วย)
6. What is the molarity of a sodium hydroxide
solution that has 12.5g dissolved in 2.0 liters.
What is the pH of the
solution? Write the dissociation for the
dissolving of the base.
(เมื่อใช้โซเดียมไฮดรอกไซด์ 12.5g
ทำเป็นสารละลาย 2.0 liters
อยากทราบว่าสารละลายจะมี pH เท่าไร
จงเขียน
สมการแสดงการแตกตัวบองเบสด้วย)
รูปภาพที่เกี่ยวข้อง

Size : 16.89 KBs
Upload : 2013-08-03 06:28:35
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|