อัตราเร็วของปฏิกิริยา (ตอนที่ 1 ) ชนิดของอัตราเร็วของปฏิกิริยา
อัตราเร็วของการเกิดปฏิกิริยาเคมี (Rate of chemical reaction ,
R,r)
ตอนที่ 1 ชนิดของอัตราเร็ว
การเกิดปฏิกิริยาเคมี คือการเปลี่ยนแปลงที่ทำให้มีสารใหม่เกิดขึ้น ไม่ว่าจะเป็นปฏิกิริยาขั้นตอนเดียวหรือหลายขั้นตอน เกิดขึ้นโดยสมบูรณ์หรือไม่สมบูรณ์ก็ได้
เมื่อมีปฏิกิริยาเคมีเกิดขึ้นย่อมมีผลให้สารตั้งต้นถูกใช้ไป
ขณะเดียวกันก็มีสารใหม่ที่เป็นผลิตภัณฑ์เกิดขึ้น ดังได้ทราบมาแล้วจากเรื่องปริมาณสารสัมพันธ์ สิ่งที่จะต้องทราบเพิ่มเติมก็คือการเกิดปฏิกิริยาเคมีต่าง
ๆ ต้องใช้เวลา มีการพูดถึงอัตราเร็วของปฏิกิริยาในเชิงคุณภาพและเชิงปริมาณ
ในเชิงคุณภาพ (qualitative) หมายถึงเป็นการพิจารณาอย่างกว้าง
ๆ ว่า
อัตราเร็วของปฏิกิริยาดูได้จากปริมาณของสารตั้งต้นที่ลดลง หรือดูจากปริมาณผลิตภัณฑ์ที่เกิดขึ้นก็ได้
ในเชิงปริมาณ
(quantitative) หมายถึงการพิจารณาว่าปริมาณสารตั้งต้นแต่ละชนิดที่ลดลงหรือปริมาณของผลิตภัณฑ์แต่ละชนิดที่เกิดขึ้นนั้น มีปริมาณเท่าไรใน 1
หน่วยเวลา
ถ้าปฏิกิริยาคือ A
+ B → AB
- ในเชิงคุณภาพเรากล่าวได้ว่า จะหาอัตราเร็วของปฏิกิริยาได้จาก การลดลงของ A หรือ B
หรือจากการเกิดขึ้นของ AB ก็ได้
- ในเชิงปริมาณเรากล่าวได้ว่า อัตราเร็วของปฏิกิริยาคิดจากการลดลงของ A หรือ B หรือการเกิดขึ้นของ AB ใน 1 หน่วยเวลา
ก็ได้
กำหนดให้ Δ แทนการเปลี่ยนแปลงของสิ่งใด ๆ เมื่อนำไปไว้หน้าสิ่งใด ๆ
ก็ให้หมายถึงปริมาณของสิ่งนั้น ๆ ที่เปลี่ยนแปลงไป เช่น Δ[A] หมายถึงปริมาณของสาร A ที่เปลี่ยนแปลงไปหรือถูกใช้ไป
Δ[B] หมายถึงปริมาณของสาร
B ที่เปลี่ยนแปลงไปหรือถูกใช้ไป
Δ[AB] หมายถึงปริมาณของสาร AB ที่เปลี่ยนแปลงไปหรือเกิดขึ้นใหม่
Δt หมายถึงเวลาที่เปลี่ยนแปลงไปหรือถูกใช้ไปในการเกิดปฏิกิริยา
จากปฏิกิริยา A
+ B → AB อัตราเร็วของปฏิกิริยาเป็นดังนี้
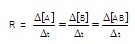
** บางครั้งให้ใช้เครื่องหมายลบ (-)เป็นสัญลักษณ์แสดงอัตราเร็วของปฏิกิริยาเมื่อคิดจากปริมาณของสารตั้งต้นที่ถูกใช้ไป
(ไม่ได้หมายความว่าอัตราเร็วของปฏิกิริยามีค่าน้อยกว่าศูนย์) และใช้ใช้เครื่องหมายบวก (+) เป็นสัญลักษณ์ว่าคิดอัตราเร็วจากปริมาณของผลิตภัณฑ์ที่เกิดขึ้น ดังนี้

ถ้าปฏิกิริยาคือ A2 + B2 → 2AB จะเห็นได้ว่าปริมาณของ A2 และ
B2
ที่ถูกใช้ไปจะเท่ากัน
แต่ไม่เท่ากับ AB ที่เกิดขึ้น
ถ้าคิดอัตราเร็วตามความเป็นจริงของการเกิดปฏิกิริยาจะเป็นดังนี้

อัตราเร็วในลักษณะนี้เป็นอัตราเร็วของการเปลี่ยนแปลงของปริมาณของสารต่าง
ๆ ที่เกิดขึ้นจริงในปฏิกิริยานั้น ๆ
** ถ้าต้องการทำให้อัตราเร็วของปฏิกิริยาเท่ากัน
จึงต้องเติม 1/จำนวนโมล ของแต่ละสารเอาไว้ข้างหน้า ดังนี้

ถ้าปฏิกิริยาทั่วไปคือ aA
+ bB → cC
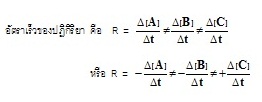
ทำให้มีค่าเท่ากันจะเป็นดังนี้
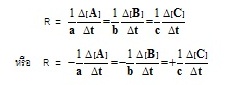
ชนิดของอัตราเร็วของปฏิกิริยา
อาจจำแนกอัตราเร็วของปฏิกิริยาออกเป็น 3
ชนิดคือ
1. อัตราเร็วเฉลี่ยของทั้งปฏิกิริยา
คืออัตราเร็วที่คิดครั้งเดียวว่าตั้งแต่เริ่มต้นจนสิ้นสุดของปฏิกิริยานั้น
ๆ สารตั้งต้นแต่ละชนิดถูกใช้ไปเท่าไรใน 1
หน่วยเวลา
หรือผลิตภัณฑ์แต่ละชนิดเกิดขึ้นเท่าไรใน
1 หน่วยเวลา อัตราเร็วชนิดนี้มีเพียง 1 ค่า เมื่อมีการเกิดปฏิกิริยาแต่ละครั้ง
2. อัตราเร็วเฉลี่ย ณ บางช่วงของปฏิกิริยา
คือเป็นการคิดอัตราเร็วของปฏิกิริยาในช่วงเวลาหนึ่ง ๆ ระหว่างการเกิดปฏิกิริยานั้น ๆ อัตราเร็วชนิดนี้มีได้หลายค่า แล้วแต่ว่าจะคิดในเวลาช่วงใดบ้าง
3. อัตราเร็ว ณ เวลาต่าง ๆ ระหว่างการเกิดปฏิกิริยา คือการคิดอัตราเร็ว ณ
เวลาใดเวลาหนึ่ง(ไม่ใช่ช่วงเวลา)
ของการเกิดปฏิกิริยานั้น ๆ
จึงมีได้มากมายหลายค่าแล้วแต่จะคิดที่เวลาใดบ้าง
กรณีนี้ต้องนำข้อมูลการเกิดปฏิกิริยาระหว่างปริมาณสารที่เปลี่ยนแปลงไปกับเวลามาเขียนกราฟ แล้วหาอัตราเร็ว ณ เวลาต่าง ๆ
จากความชัน
(Slope) ของกราฟ ณ เวลานั้น ๆ
อัตราเร็วของปฏิกิริยาจะมากหรือน้อย
มีจุดเริ่มต้นอยู่ที่สมบัติเฉพาะตัวของสารแต่ละชนิด
ว่ามีความว่องไวต่อการเกิดปฏิกิริยาเพียงใด จากนั้นจะมีปัจจัยอื่น ๆ เป็นปัจจัยร่วมที่จะทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้นหรือละลงได้
(คลิ้ก ชม Rate of reaction)
ตัวอย่าง ปฏิกิริยา
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) วัดความเข้มข้นของ H2SO4 ที่เปลี่ยนไป ณ เวลาต่าง ๆ ตั้งแต่เริ่มต้นจนปฏิกิริยาสิ้นสุด ได้ผลดังตาราง
|
[H2SO4] mol/dm3
|
เวลา (min)
|
|
1.00
|
0.00
|
|
0.60
|
1.00
|
|
0.30
|
2.00
|
|
0.10
|
3.00
|
|
0.00
|
4.00
|
- จงหาอัตราเร็วเฉลี่ยของปฏิกิริยาในหน่วย mol/dm3.min
- จงหาอัตราเร็วของปฏิกิริยาในช่วงเวลาระหว่างนาทีที่
2-3 ในหน่วย mol/dm3.min
- จงหาอัตราเร็ว ณ นาทีที่
1.5 ของการเกิดปฏิกิริยา ในหน่วย
mol/dm3.min
วิธีทำ
1. อัตราเร็วเฉลี่ยของปฏิกิริยาในหน่วย mol/dm3.min เป็นดังนี้

=
0.25 mol/dm3.min ตอบ
- อัตราเร็วของปฏิกิริยาในช่วง 2-3
นาที ในหน่วย mol/dm3.min เป็นดังนี้
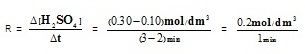
= 0.20
mol/dm3.min ตอบ
- อัตราเร็ว ณ นาทีที่
1.5 ของการเกิดปฏิกิริยา ในหน่วย
mol/dm3.min เป็นดังนี้
นำข้อมูลของการเกิดปฏิกิริยามาเขียนกราฟได้ดังนี้
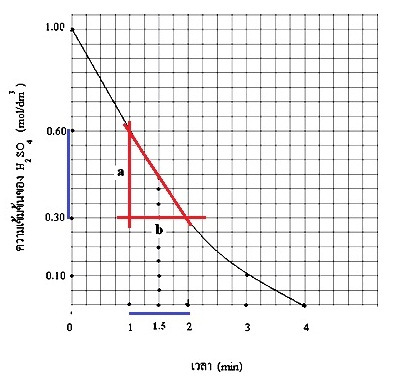
อัตราเร็ว ณ นาทีที่ 1.5 หาได้จากความชันของกราฟ ณ เวลาดังกล่าว จะเห็นได้ว่า a ก็คือความเข้มข้นของ H2SO4 ที่เปลี่ยนแปลงไป หรือ Δ[H2SO4] ในขณะที่
b ก็คือเวลาที่เปลี่ยนแปลงไป หรือ Δt
R
ณ นาทีที่ 1.5 = a/b = Δ[H2SO4]/ Δt = (0.60 - 0.30 mol/dm3)/(2-1)min = 0.3 mol/dm3/1 mim
= 0.3
mol/dm3.min
ตอบ
หมายเหตุ
อัตราเร็วของปฏิกิริยาทั่วไปจะเร็วมากเมื่อเริ่มต้นแล้วค่อย ๆ
ลดลงเมื่อเวลาผ่านไป
แบบฝึกหัด
1. A
chemist wishes to
determine the rate of reaction of zinc with hydrochloric acid. The
equation for the reaction
is:
(นักเคมีต้องการหาอัตราเร็วของปฏิกิริยาระหว่างสังกะสีกับกรดไฮโดรคลอริก ซึ่งมีปฏิกิริยาดังสมการ)
Zn(s) + 2HCl(aq) → H2(g)
+ ZnCl2(aq)
A piece of zinc is dropped into 1.00 L of 0.100 M HCl and the
following data were obtained:
(เมื่อใส่สังกะสีชิ้นหนึ่งลงไปในสารละลายกรดไฮโดรคลอริก ความเข้มข้น
0.100 M จำนวน
1.00 ลิตร เมื่อติดตามการ
เกิดปฏิกิริยาพบว่าเป็นดังตาราง)
|
Time(s)
|
Mass of Zinc
|
|
0
|
0.016 g
|
|
4
|
0.014 g
|
|
8
|
0.012 g
|
|
12
|
0.010 g
|
|
16
|
0.008 g
|
|
20
|
0.006 g
|
a) Calculate the Rate of Reaction in grams of Zn
consumed per second.
(จงคำนวณหาอัตราเร็วของปฏิกิริยาจากการลดลงของ
Zn ในหน่วยกรัม/วินาที) ตอบ 5.0 x 10-4 g/s
b) Calculate the Rate of Reaction in moles of Zn
consumed per second.
(จงคำนวณหาอัตราเร็วของปฏิกิริยาจากการลดลงของ Zn ในหน่วยโมล/วินาที) ตอบ 7.6 x 10-6 mol/s
c) What will happen to the [H+] as the reaction proceeds?
(ความเข้มข้นของ H+ จะเปลี่ยนแปลงอย่างไรเมื่อเกิดปฏิกิริยา)
d) What will happen to the [Cl-] as the reaction proceeds?
(ความเข้มข้นของ Cl- จะเปลี่ยนแปลงอย่างไรเมื่อเกิดปฏิกิริยา)
2. When magnesium is reacted
with dilute hydrochloric acid (HCl), a reaction occurs in which
hydrogen gas and magnesium
chloride is formed.
(เมื่อแมกนีเซียมทำปฏิกิริยากับสารละลายกรดไฮโดรคลอริกเจือจาง จงได้ก๊าซไฮโดรเจนและแมกนีเซียมคลอไรด์เป็น
ผลิตภัณฑ์)
a) Write a balanced formula equation for
this reaction. (จงเขียนและดุลสมการแสดงปฏิกิริยาที่เกิดขึ้น)
b) If the rate of consumption of magnesium is 5.0 x 10-9
mol/s, find the mass of Mg consumed in 5.0 minutes.
(ถ้าอัตราเร็วของการให้แมกนีเซียมคือ 5.0
x 10-9 mol/s
อยากทราบว่าถ้าเวลาผ่านไป 5.0 นาที จะใช้แมกนีเซียมไปกี่
กรัม) ตอบ 3.6 x 10-5
g
3. Given the reaction:
CO2(g) +
NO (g) → CO(g) +
NO2(g)
colourless colourless colourless brown
Suggest a method which could be used to
monitor the rate of this reaction.
(จากปฏิกิริยาและข้อมูลที่กำหนดให้ จงเสนอวิธีหาอัตราเร็วของการเกิดปฏิกิริยาดังกล่าวนี้)
Why wouldn’t total pressure be a good way to monitor the rate of this
reaction?
(เหตุใดจึงใช้ความดันรวมในการหาอัตราเร็วของปฏิกิริของปฏิกิริยานี้ไม่ได้)
4. Given the following reaction and graph:
CaCO3(s) +
2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
a) Calculate the average rate of reaction in mL CO2 /min
for the time interval 0 – 2 min.
(จงคำนวณหาอัตราเร็วเฉลี่ยของปฏิกิริยา ในหน่วย
mL ของ CO2/นาที ) ตอบ 17 mL/min
b) Calculate the average rate of reaction in mL CO2 /min
for the time interval 2 – 4 min.
(จงคำนวณหาอัตราเร็วเฉลี่ยของปฏิกิริยา ระหว่างนาทีที่ 2-4
ในหน่วย mL
ของ CO2/นาที ) (ตอบ
7.5 ml/min)
5. Ent.43 ต.ค. สาร X
สามารถสลายตัวได้ดังสมการ 3X →
5Y + 6Z
วัดความเข้มข้นของสารละลาย X ที่เปลี่ยนไปในขณะที่เกิดปฏิกิริยาเป็นดังตารางต่อไปนี้
|
เวลา(วินาที)
|
[X] (mol/dm3)
|
|
0.00
5.00
10.00
15.00
20.00
|
1.000
0.850
0.750
0.700
0.670
|
ถ้าอัตราการเกิดปฏิกิริยาเฉลี่ยในช่วง 15 ถึง
20 วินาที มีค่าคงที่
ความเข้มข้นของสาร X ในหน่วย mol/dm3 ที่เวลา 17
วินาที มีค่าเท่าไร
1.
0.670 2.
0.688 3.
0.690 4.
0.670
6. Ent.44 มี.ค. สาร
X สลายตัวได้ดังสมการ 3X → 5Y + 6Z
เมื่อวัดความเข้มข้นของสาร X ในขณะที่เกิดปฏิกิริยา
พบว่าได้ข้อมูลดังตารางต่อไปนี้
|
เวลา (วินาที)
|
[X] (mol/dm3)
|
|
0.00
5.00
10.00
15.00
20.00
|
1.000
0.850
0.750
0.700
0.670
|
ที่เวลา 5 วินาที สาร Y
จะมีความเข้มข้นกี่โมล/ลูกบาศก์ก์เดซิเมตร
1. 0.15 2.0.25 3. 0.85 4. 1.42
7. Ent.47 ต.ค. A B และ
C
อยู่ในภาชนะเดียวกัน A ทำปฏิกิริยากับ B แล้วได้สาร X ดังสมการ
A +
2B è X และ A ทำปฏิกิริยากับ C ได้สาร
Y การวัดมวลของสารที่เวลาต่าง ๆ
ได้ผลดังนี้
|
เวลา(นาที)
|
จำนวนโมล
|
|
A
|
B
|
C
|
X
|
Y
|
|
0
1
2
|
20.0
18.5
17.0
|
10.0
9.0
8.0
|
2.0
1.5
1.0
|
0.0
0.5
1.0
|
0.0
0.5
1.0
|
A กับ C เกิดปฏิกิริยาตรงตามข้อใด
และสิ้นสุดในเวลากี่นาที
1. A +
C è Y 4 นาที 2.
2A + C è Y 4 นาที
3. A + 2C è Y 3 นาที 4.
2A + C è Y 3นาที
8. O-Net 50
ปฏิกิริยาเคมีระหว่างลวดแมกนีเซียมกับสารละลายกรดซัลฟิวริกเป็นดังสมการ
Mg(s) + H2SO4(aq) → MgSO4(aq) + H2(g)
บันทึกเวลาในการเกิดแก๊ส H2 เริ่มต้นจนถึงปริมาตร 5 cm3 ดังตาราง
|
ปริมาตร H2 ที่เกิด (cm3 )
|
เวลาที่ใช้ (s)
|
|
1
|
4
|
|
2
|
6
|
|
3
|
9
|
|
4
|
14
|
|
5
|
20
|
จากข้อมูลในตารางข้อใดถูก
|
|
อัตราการเกิดปฏิกิริยา (cm3/s)
|
|
|
อัตราเฉลี่ย
|
อัตราช่วงเกิดแก๊ส H2 ปริมาตร 3-5 cm3
|
|
1.
|
0.16
|
0.18
|
|
2.
|
0.25
|
0.18
|
|
3.
|
0.50
|
0.25
|
|
4.
|
0.25
|
0.27
|
รูปภาพที่เกี่ยวข้อง

Size : 9.72 KBs
Upload : 2013-07-16 05:53:36
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|