พันธะเคมี ตอนที่ 4(ต่อ) แบบฝึกหัด พันธะไอออนิก
แบบฝึกหัด
1. (Ent.41 ต.ค.)
นักเรียนผู้หนึ่งดำเนินการทดลองเพื่อเตรียมเกลือชนิดหนึ่งโดย
- ผสมสารละลาย
X ปริมาณ 10 cm3 กับสารละลาย
Y ปริมาตร 10 cm3
- คนให้เข้ากันเกิดตะกอนของเหลือ
- กรองเอาเกลือออก
- นำเกลือมาอบให้แห้งที่ 100 .C เป็นเวลา 20 นาที
เกลือที่นักเรียนผู้นี้เตรียมได้น่าจะเป็นสารใด
1. แมกนีเซียมโบรไมด์ 2. แคลเซียมคลอไรด์
3. เลด (II) ไนเตรต 4.แบเรียมซัลเฟต
2. (Ent.42 ต.ค.) จากสูตรของ NaClO3 SiCl4 CO2 Li2CO3 จงเขียนสูตรของสารประกอบต่อไปนี้ เรียงตามลำดับ
จาก เจอร์มาเนียม (IV) โบรไมด์ โซเดียมซิลิเคต ซิลิคอน (IV) ซัลไฟด์ โพแทสเซียมโบรเมต
1. GeBr4 NaSiO3 SiS3 K2BrO3 2. GeBr4 Na2SiO4 Si4S KBrO3
3. GeBr2 Na2SiO4 SiS2 KBrO3 4.
GeBr4 Na2SiO3 SiS2 KBrO4
3. (Ent.42 ต.ค.) พิจารณาแผนภาพการเปลี่ยนแปลงพลังงานต่อไปนี้
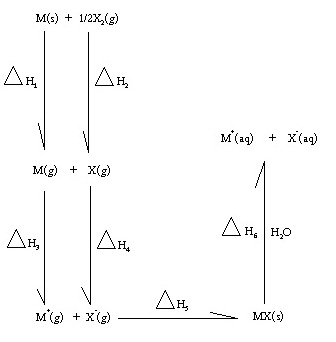
การระบุชื่อพลังงานในข้อใดผิด
- ∆H3 คือพลังงานสลายพันธะ
- ∆H4 คือ สัมพรรคภาพอิเล็กตรอน
- ∆H5 คือ พลังงานแลตทิช
- ∆H6 คือพลังงานไฮเดรชัน
4. (Ent.43 มี.ค.) การละลายของเกลือ LiCl(s) ในน้ำมีขั้นตอนดังนี้
1. LiCl(s)
→
Li+(g) + Cl-(g)
2. Li+(g) + Cl-(g) → Li+(aq) + Cl-(aq)
รวม LiCl(s) → Li+(aq) + Cl-(aq)
กำหนดพลังงานแลตทิช = 834 kJ mol-1 พลังงานไฮเดรชัน = 884 kJ mol-1 อยากทราบว่าปฏิกิริยาทั้งสามเป็นปฏิกิริยาชนิดใด
และขั้นตอนรวมมีพลังงานเกี่ยวข้องกี่กิโลจูลต่อโมล
|
|
ชนิดปฏิกิริยา
|
พลังงาน
|
|
|
1
|
2
|
รวม
|
|
1.
|
คาย
|
ดูด
|
ดูด
|
50
|
|
2.
|
ดูด
|
ดูด
|
ดูด
|
1,718
|
|
3.
|
ดูด
|
คาย
|
คาย
|
50
|
|
4.
|
คาย
|
คาย
|
คาย
|
1,718
|
5. (Ent.43 มี.ค.) ปฏิกิริยาในข้อใดเกิดตะกอนทั้ง
2 ปฏิกิริยา
1. CuSO4 + NaNO3 และ Zn(NO3)2 + HCl
2. NaCl + KNO3 และ FeCl3 + HNO3
3. AgNO3 + KCl และ Cu(NO3)2 + NaCl
4. AgNO3 + KI และ Pb(NO3)2 + Na2SO4
6. (Ent.43 ต.ค.) ข้อมูลแสดงค่าพลังงานที่เกี่ยวข้องกับการละลายของสาร A B และ C เป็นดังนี้
|
สาร
|
พลังงานไฮเดชัน(kJ/mol)
|
พลังงานแลตทิช(kJ/mol)
|
|
A
|
745
|
750
|
|
B
|
590
|
550
|
|
C
|
690
|
700
|
ถ้าใช้สาร
A B
และ C จำนวนโมลเท่ากันละลายในน้ำที่มีปริมาตร 100
cm3 การเปรียบเทียบอุณหภูมิของแต่ละสารละลาย ข้อใดถูกต้อง
1. A > B > C 2. B
> A > C 3. B > C > A 4. C
> A > B
7. (Ent.43 ต.ค.) กำหนดข้อมูลของธาตุ X Y
Z ดังนี้
I. ธาตุ
X มีค่า IE1 < IE2 << IE3
II.
ธาตุ Y เป็นธาตุหมู่เดียวกับ 13Al
III. ไอโซโทปหนึ่งของธาตุ
Z ไม่มีนิวตรอน
สูตรของสารประกอบซัลไฟด์ของ X
Y และ Z ควรเป็นดังข้อใด
1.
XS Y2S3 Z2S 2. XS Y2S3 ZS 3.
XS Y3S2 ZS 4. XS Y3S2 Z2S
8. (Ent.43 ต.ค.) ถ้า O
P Q และ R เป็นธาตุที่มีเลขอะตอม
7 11
17 และ 20 ตามลำดับ สูตรของสารประกอบ
ข้อใดเป็นไปได้
1. OQ 2. PO 3. O2P3 4. R3O2
9. (Ent.44 มี.ค.) ธาตุ สามารถเกิดสารประกอบกับธาตุ สารประกอบที่เกิดขึ้นควรมีมวลโมเลกุลเท่าใด
1. 168 2. 248 3. 256 3. 328
10. (Ent.44 ต.ค.) ปฏิกิริยาของสารคู่ใดต่อไปนี้มีตะกอนเกิดขึ้น
ก. CdCl2(aq) + (NH4)2S(aq) ข. Cu(NO3)2(aq) + Na2CO3(aq)
ค. H2SO4(aq) + MgCO3(s)
1. ก ข 2. ข ค 3. ก ค 4. ก ข ค
11. (Ent.45 มี.ค.) เมื่อนำสารประกอบไอออนิก MX มาละลายน้ำ
มีกระบวนการที่เกี่ยวข้องดังนี้
พลังงานที่เกี่ยวข้อง
MX(s) → M+(g) + X-(g) E1
M+(g)
+ X-(g) →
M+(aq) + X-(aq) E2
ข้อสรุปใดถูกต้อง
- เมื่อนำ MX ละลายน้ำแล้วเกิดความร้อนขึ้น แสดงว่า
E1
> E2
- ถ้า E1 > E2 แสดงว่า MX ไม่ละลายน้ำ
- ถ้า E1 = E2 แสดงว่า MX ไม่ละลายน้ำ
- ความสามารถในการละลายน้ำของ
MX ไม่ขึ้นกับค่า E1 และ E2
12. (Ent.47 มี..ค.) กำหนดค่าพลังงานไอออไนเซชัน (kJ/mol) ของธาตุ X Y และ Z ซึ่งเป็นธาตุสมมติดังนี้
|
ธาตุ
|
IE1
|
IE2
|
IE3
|
IE4
|
IE5
|
|
X
|
520
|
7200
|
12000
|
|
|
|
Y
|
900
|
1850
|
15000
|
21000
|
|
|
Z
|
800
|
2400
|
3700
|
25000
|
32000
|
ธาตุใดสามารถรวมกับฟอสเฟตในอัตราส่วน 3:2 และธาตุใดสามารถรวมกับน้ำได้ว่องไวที่สุดตามลำดับ
1. Y และ X 2. Y และ Z 3. Z และ X 4. Z และ Y
13. (Ent.47 ต.ค.)
|
ธาตุ
|
พลังงานไอออไนเซชัน
(MJ/mol)ลำดับที่
|
|
1
|
2
|
3
|
4
|
|
A
|
0.4
|
3.1
|
4.4
|
5.9
|
|
B
|
0.6
|
1.1
|
4.9
|
6.5
|
|
C
|
0.6
|
1.8
|
2.7
|
11.6
|
|
D
|
0.7
|
1.5
|
7.7
|
10.5
|
สารประกอบออกไซด์ของธาตุใดมีสูตรเหมือนกัน
1. A กับ B 2.
A กับ
C 3. B กับ D 4. A กับ D
14. (A-net.48)การผสมสารละลายในข้อใดมีปฏิกิริยาเกิดขึ้น
และสามารถเขียนสมการไอออนิกได้ทั้งคู่
|
|
สารละลายผสม I
|
สารละลายผสม II
|
|
1.
|
NaCl + AgNO3
|
KI + Na2CO3
|
|
2.
|
Ca(OH)2
+ Pb(NO3)2
|
Li2SO4
+ BaCl2
|
|
3.
|
BaCl2
+ Na2SO4
|
NH4CN
+ Na2HPO4
|
|
4.
|
AgNO3
+ KBr
|
Mg + HCl
|
15. (O-net.49)
เลขเชิงอะตอมของ F และ
Ca เท่ากับ 9 และ 20
ตามลำดับ
ธาตุทั้งสองรวมกันเป็นสารไอออนิก
การจัดเรียงอิเล็กตรอนของไออนทั้งสองเป็นดังข้อใด
|
|
แคลเซียมไอออน
|
ฟลูออไรด์ไอออน
|
|
1.
|
2 8
8
|
2 8
2
|
|
2.
|
2 8
8
|
2 8
|
|
3.
|
2 8
8 2
|
2 7
|
|
4.
|
2 8
8 1
|
2 8
1
|
16. (A-net.49) ฉลากที่ติดขวดใส่สารประกอบไอออนิก 4
ชนิดหลุดออก
เมื่อนักเรียนคนหนึ่งทำการทดลองโดยละลายสารประกอบทั้ง 4
ในน้ำ
แล้วผสมสารละลายแต่ละชนิดเข้าด้วยกัน
พบว่าได้ผลการทดลองดังตาราง
|
สารละลาย
|
ผลการทดลองเมื่อผสมกับสารละลาย
|
|
ก
|
ข
|
ค
|
ง
|
|
ก
|
-
|
ตะกอนขาว
|
สารละลายใส
|
ตะกอนขาว
|
|
ข
|
ตะกอนขาว
|
-
|
ตะกอนเหลือง
|
สารละลายใส
|
|
ค
|
สารละลายใส
|
ตะกอนเหลือง
|
-
|
สารละลายใส
|
|
ง
|
ตะกอนขาว
|
สารละลายใส
|
สารละลายใส
|
-
|
จากผลการทดลอง
สารประกอบไอออนิกทั้ง 4 ชนิดควรเป็นดังข้อใด
|
|
สาร ก
|
สาร ข
|
สาร ค
|
สาร ง
|
|
1.
|
Na2CO3
|
Pb(NO3)2
|
KI
|
Ca(NO3)2
|
|
2.
|
Ca(NO3)2
|
KI
|
Pb(NO3)2
|
Na2CO3
|
|
3.
|
Na2CO3
|
Pb(NO3)2
|
Ca(NO3)2
|
KI
|
|
4.
|
Na2CO3
|
Ca(NO3)2
|
KI
|
Pb(NO3)2
|
17. (A-net.49)
กำหนดให้
ก. พลังงานการเกิด CaCl2 และ CaBr2 มีค่าดังนี้
Ca(s) + Cl2(g) → CaCl2(s) ; = -800 kJ/mol
Ca(s) + Br2(g) → CaBr2(g) ; = -650 kJ/mol
ข. ค่าสัมพรรคภาพอิเล็กตรอน (EA) ของ Cl
และ Br และค่าพลังงานการรวมตัว (D)
ของแก๊ส Cl2
และ
Br2 มีค่าดังตาราง
|
Cl
|
Br
|
|
EA = -350
kJ/mol
|
EA = -300
kJ/mol
|
|
D ของ Cl2(g) = 250 kJ/mol
|
D ของ Br2(g) =
200 kJ/mol
|
ถ้าพลังงานแลตทิชของ CaCl2 และ CaBr2 =
X และ Y
kJ/mol ตามลำดับ การเปรียบเทียบค่าตัวเลข (ไม่คิดเครื่องหมาย) พลังงานแลตทิชข้อใดถูกต้อง
1. X > Y 2. Y > X
3. X = 1.4Y 4. เปรียบเทียบไม่ได้เพราะข้อมูลไม่เพียงพอ
18.(เคมีโอลิมปิค 47)
พิจารณาตารางต่อไปนี้
|
สาร
|
พลังงานที่ใช้ในการแยกของแข็ง
ออกเป็นอนุภาคเล็ก ๆ (kJ/mol)
|
พลังงานที่เกิดจากแรงยึดเหนี่ยวระหว่างอนุภาคของสารกับโมเลกุลของน้ำ (kJ/mol)
|
|
A
|
768.3
|
764.5
|
|
B
|
581.7
|
618.4
|
|
C
|
705.8
|
696.2
|
การละลายน้ำของสาร A
B และ C
ข้อใดกล่าวได้ถูกต้อง
- สาร A ละลายน้ำแล้วพลังงานของสาร
A จะสูงขึ้น
- การละลายของสาร B เป็นการเปลี่ยนแปลงประเภทดูดพลังงาน
- สาร C ละลายน้ำแล้วอุณหภูมิของน้ำจะต่ำลง
- การละลายของสาร A และ B เป็นการเปลี่ยนแปลงประเภทดูดพลังงาน
19. (เคมีโอลิมปิค 47) ข้อใดผิดเกี่ยวกับการละลายของสารประกอบไอออนิก
1. เมื่อสารประกอบไอออนิกละลายน้ำ สารละลายจะนำไฟฟ้าได้
2. ในสารละลาย น้ำจะหันด้านไอโดรเจนเข้าหาไอออนลบ และหันด้านออกซิเจนเข้าหาไอออนบวก
3. เมื่อละลายสารประกอบชนิดหนึ่งในน้ำปรากฏว่าอุณหภูมิของระบบเพิ่มขึ้น แสดงว่าพลังงานไฮเดรชันของ
สารประกอบนั้นมีค่าน้อยกว่าพลังงานโครงร่างผลึก
4. ถ้าการละลายของสารประกอบไอออนิกในน้ำดีขึ้นเมื่อเพิ่มอุณหภูมิให้แก่ระบบ แสดงว่าเป็นปฏิกิริยาแบบ
ดูดความร้อน
20. (เคมีโอลิมปิค 44) สารประกอบต่อไปนี้สารใดไม่ละลายน้ำ
1. NaClO3 BaSO4 AgNO3 PbCl2
2. BaSO4 PbCl2 Cu2O AgBr
3. HCl
NH3 NaClO3 CuSO4
4. BaSO4 AgNO3
CuSO4 Pb(C2H3O2)2
21.
Which of the following is the correct formula for a
compound of nickel and oxygen?
(สูตรของสารประกอบระหว่างนิกเกิลกับออกซิเจนข้อใดถูกต้อง)
a) NiO4 b) NiO c) Ni2O d) Ni2O
e) NiO2
22.
Which of the following is the correct formula for a compound
of magnesium and nitrogen?
(สูตรของ สารประกอบระหว่างแมกนีเซียมกับไนโตรเจนข้อใดถูกต้อง)
a) Mg3N b) Mg3N2
c) Mg2N3 d) MgN e) Mg2N
23. Which of the
following is the correct formula for a compound of cadmium and chlorine?
(สูตรของสารประกอบระหว่างแคดเมียมกับคลอรีนข้อใดถูกต้อง)
a)
CdCl3 b)
CdCl2 c)
Cd3Cl2 d)
CdCl4 e)
CdCl
24. The formula of
an oxide of gallium is Ga2O3. What is the formula of the
perchlorate of gallium with the
same
oxidation number? (Ans.d)
(ถ้าสารประกอบออกไซด์ของแกลเลียมคือ
Ga2O3 อยากทราบว่าสารประกอบ
เปอร์คลอเรตของแกลเลียมจะเป็นดังข้อใด ถ้าเลขออกซิเดชันของแกลเลียมเป็นค่าเดิม)
a)
GaClO4 b)
Ga(ClO4)2 c)
Ga3(ClO4)2 d) Ga(ClO4)3
e) Ga2(ClO4)3
25. The formula of
a carbonate of yttrium is Y2(CO3)3. What is
the formula of the nitrate of yttrium with the
same
oxidation number? (Ans.d) (ถ้าสารประกอบคาร์บอเนตของ yttrium คือ Y2(CO3)3 อยากทราบว่า
สารประกอบไนเตรตจะเป็นดังข้อใด ถ้าเลขออกซิเดชันของ
yttrium
เป็นค่าเดิม)
a)
YNO3 b) Y3NO3
c) Y3(NO3)2
d) Y(NO3)3
e) Y2(NO3)3
26. If the
formulas of calcium tungstate and cerium tungstate are CaWO4 and Ce2(WO4)3,
what is the formula
of
cerium iodate? (Ans.d) (ถ้าสูตรของแคลเซียมทังสเตตและซีเรียมทังสเตตคือ CaWO4 และ
Ce2(WO4)3 อยาก
ทราบว่าสูตราของซีเรียมไอโอเดตจะเป็นดังข้อใด)
a)
CeIO3 b)
Ce2IO3 c)
Ce3(IO3)2 d) Ce(IO3)3 e) Ce2(IO3)3
27. Elements of Groups IIIA and VIIA of the
periodic table tend to form ions with ___ charges. (Ans.a)
(เมื่อธาตุหมู่ 2A และ
7A เปลี่ยนเป็นไอออน จะได้ไอออนดังข้อใด)
a)
+3 and -1 b)
+3 and +7 c) +3 and +1 d) +3 and -7 e) -3 and +7
28. An ionic bond is formed between two atoms:
(Ans.a)
(การเกิดพันธะไอออนิกระหว่างอะตอม 2
อะตอม เป็นดังข้อใด)
a)
by transfer of electrons from metallic to nonmetallic elements.(โดยการถ่ายเทอิเล็กตรอนจากโลหะสู่
อโลหะ)
b) whose difference in electronegativities is less
than 1.7. (มีค่าอิเล็กโตรเนกาติวิตีต่างกันน้อยกว่า 1.7)
c) by sharing of electrons. (โดยการใช้อิเล็กตรอนร่วมกัน)
d) by changes in their nuclei. (โดยการเปลี่ยนแปลงในนิวเคลียส)
e) which are both nonmetals. (อะตอมทั้งคู่ต้องเป็นอโลหะ)
29. Consider the following elements and arrange
them in order of increasing number of electrons depicted
in
electron dot symbols. Which one occupies the intermediate position in the
series? (Ans.a) Si Mg
Cl
Ga S (ถ้าพิจารณาจากการจัดอิเล็กตรอนแล้ว
ธาตุใดจะอยู่ในตำแหน่งของธาตุถึ่งโลหะ)
a)
Si b) S c)
Mg d) Ga e) Cl
30. Consider the following elements and arrange
them in order of increasing number of electrons depicted
in
electron dot symbols. Which one occupies the intermediate position in the
series? (Ans.a) Al Rb
Ba
S P (ถ้าพิจารณาจากการจัดอิเล็กตรอนแล้ว ธาตุใดจะอยู่ในตำแหน่งของธาตุถึ่งโลหะ)
a)
Al b)
P c) Rb
d) S e) Ba
31. Sodium chloride
(NaCl) exists as a ccp structure in which the Na+ is located in an
octahedral hole. It
follows
that Na+ has ____ nearest neighbor Cl- ions and Cl-
has ____ nearest neighbor Na+ ions. (Ans.a)
(ในผลึกของ NaCl
อยากทราบว่า Na+
ถูกล้อมรอบด้วย Cl- กี่ไอออน และ Cl- ถูกล้อมรอบด้วย
Na+ กี่ไอออน)
a)
6, 6 b)
4, 6 c) 4,
4 d) 2, 2 e) 8, 8
32. CsI exists in a simple cubic arrangement. How many Cs+ and I- ions are contained in the unit cell?
(Ans.a) (ในหน่วยเซลล์ของ CsI ประกอบด้วย Cs+ และ I- อย่างละกี่ไอออน )
a) 1, 1 b) 4, 2 c) 2, 4 d) 4, 4 e) 2, 2
33. Consider the following ionic substances and arrange them in order of increasing lattice energy. (Ans.c)
CaS MgS MgO (จากสารไอออนิกที่กำหนด ถ้าเรียงลำดับตามพลังงานโครงร่างผลึกจะเป็นดังข้อใด)
a) CaS > MgO > MgS b) MgS > CaS > MgO c) MgO > MgS > CaS
d) MgO > CaS > MgS
34. The ionic radii of some ions are: Na+,
0.095 nm; K+, 0.133 nm; Ca2+, 0.099 nm; Ni2+,
0.069 nm; Ba2+,
0.135
nm; Ag+, 0.126 nm; S2-, 0.184 nm; Br-, 0.195
nm; O2-, 0.140 ; Cl-, 0.181 nm. Consider the following
compounds
and arrange them in order of increasing lattice energy and select the compound
which is of
intermediate
value in the series. (Ans.c)
BaO
NaBr AgCl NiS CaS ; (ถ้าขนาดไอออนของ Na+= 0.095 nm; K+=0.133 nm; Ca2+=
0.099 nm; Ni2+=
0.069
nm; Ba2+= 0.135 nm; Ag+= 0.126 nm; S2-= 0.184
nm; Br-= 0.195 nm; O2-=0.140 ; Cl-= 0.181 nm ถ้า
เรียงลำดับสสารไอออนิกที่เกิดขึ้นตามพลังงานโครงร่างผลึกจากน้อยไปมาก สารใดจะอยู่ตรงกลาง)
a)
AgCl b) BaO c) NiS d) NaBr e) CaS
35. Consider the
following ionic substances and arrange them in order of increasing lattice
energy. (Ans.c)
NaI KI
LiCl ; (การเรียงลำดับสารไอออนิกตามค่าพลังงานโครงร่างผลึกจากน้อยไปมากเป็นดังข้อใด)
a)
NaI > KI > LiCl b)
LiCl > KI > NaI c)
LiCl > NaI > KI d)
KI > NaI > LiCl
36. Writing
Ionic Formulas (จงเขียนสูตรของสารไอออนิก)
|
|
Cl-
|
NO3-
|
S2-
|
CO32-
|
N3-
|
PO43-
|
OH-
|
|
Na+
|
|
|
|
|
|
|
|
|
NH4+
|
|
|
|
|
|
|
|
|
Sn2+
|
|
|
|
|
|
|
|
|
Hg22+
|
|
|
|
|
|
|
|
|
Al3+
|
|
|
|
|
|
|
|
|
Sn4+
|
|
|
|
|
|
|
|
37. Naming
Ionic Compounds (จงเขียนสูตรและเรียกชื่อสารไอออนิกจากไอออนที่กำหนด)
|
Cation
|
Anion
|
Formula
|
Name
|
|
Cu2+
|
OH-
|
|
|
|
Ba2+
|
SO42-
|
|
|
|
NH4+
|
Cr2O72-
|
|
|
|
Ag+
|
C2H3O2-
|
|
|
|
Fe3+
|
S2-
|
|
|
38. What are the formulas of the polyatomic ions: (จงเขียนสูตรของไอออนที่มีชื่อต่อไปนี้)
phosphate nitrite
sulfate cyanide
bisulfite chlorite
39. Write the ions present in the following
salts and predict their formulas:
(จงแสดงไอออนที่มีอยู่ในสารไอออนิกที่กำหนด
และเชียนสูตรของสารไอออนิกนั้น ๆ)
potassium bromide calcium
carbonate
magnesium iodide
lithium oxide
aluminum sulfate ammonium
chlorate
beryllium phosphate
40. Name the following ionic salts: (จงเรียกชื่อสารไอออนิกต่อไปนี้)
|
(NH4)2SO4
KHCO3
Ca(NO3)2
|
Co2(SO4)3
NiSO4
AlPO4
|
41. Solutions of lead nitrate and
potassium chloride are mixed. Write over all and ionic equation.
(จงเขียนสมการไอออนิกแบบรวมที่เกิดจากการผสมสารละลายเลดไนเตรตกับสารละลายโพแทสเซียมคลอไรด์)
42. Solutions of sodium sulfate and
calcium bromide are mixed. Write over all and ionic equation.;
(จงเขียนสมการไอออนิกแบบรวม
เมื่อผสมสารละลายโซเดียมซัลเฟตกับสารละลายแคลเซียมโบรไมด์ )
43.
Solutions of aluminum acetate and lithium hydroxide are mixed. Write
over all and ionic equation. ; (จง
เขียนสมการไอออนิกแบบรวม เมื่อผสมสารละลายอลูมิเนียมอะซิเตต กับสารละลายลิเทียมไฮดรอกไซด์
)
44.
Solutions of iron(III) sulfate and sodium sulfide are mixed. Write over
all and ionic equation. ;
(จงเขียนสมการไอออนิกแบบรวม
เมื่อผสมสารละลายอลูมิเนียมอะซิเตต กับสารละลายลิเทียมไฮดรอกไซด์ )
45.Solutions of aluminum sulfate and
calcium hydroxide are mixed. Write over all and ionic equation. ;
(จงเขียนสมการไอออนิกแบบรวม
เมื่อผสมสารละลายอลูมิเนียมซัลเฟตกับสารละลายแคลเซียมไฮดรอกไซด์ )
46.
Solutions of potassium chromate and lead acetate are mixed. Write over
all and ionic equation.
(จงเขียนสมการไอออนิกแบบรวม
เมื่อผสมสารละลายโพแทสเซียมโครเมตกับสารละลายเลดอะซิเตต)
47.
Solutions of silver nitrate and ammonium sulfide are mixed. Write over all
and ionic equation.
(จงเขียนสมการไอออนิกแบบรวม
เมื่อผสมสารละลายซิลเวอร์ไนเตรตกับสารละลายแอมโมเนียมซัลไฟด์)
รูปภาพที่เกี่ยวข้อง

Size : 40.92 KBs
Upload : 2012-11-17 06:36:55
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|





 คะแนนโหวด
คะแนนโหวด

