ของแข็ง ของเหลว แก๊ส (ตอนที่ 11) กฎความดันย่อยของดอลตัน
กฎความดันย่อยของดอลตัน (Dalton,s partial pressure law)
ถ้าเรานำแก๊สตั้งแต่ 2 ชนิดขึ้นไปมาผสมกัน โดยแก๊สไม่ทำปฏิกิริยากัน โมเลกุลของแก๊สแต่ละชนิดก็จะวิ่งชนผนังของภาชนะที่บรรจุแก๊ส การชนของแก๊สแต่ละชนิดย่อมทำให้เกิดความดัน ถ้าคิดเฉพาะความดันที่เกิดจากการชนของแก๊สแต่ละชนิดเรียกว่า ความดันย่อย (partial pressure) แต่ถ้านำความดันที่เกิดจากแก๊สแต่ละชนิดมารวมกันเรียกว่า ความดันรวม (Total pressure)
จอห์น ดาลตันได้สนใจศึกษาเกี่ยวกับ ความดันของแก๊สผสมต่าง ๆ และตั้งกฎความดันย่อยของแก๊สขึ้นมาในปี ค.ศ. 1801 (พ.ศ.2344) ความว่า 'ความดันรวมของแก๊สผสมจะเท่ากับผลรวมของความดันย่อยของแก๊สแต่ละชนิดที่ผสมกัน '
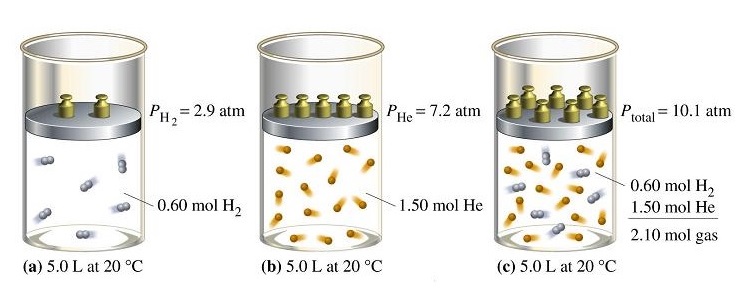
จากรูป (a) คือภาชนะซึ่งบรรจุแก๊ส H2 มีความดัน 2.9 atm
(b) คือภาชนะบรรจุแก๊ส He มีความดัน 7.2 atm
(c) คือภาชนะที่นำแก๊สจาก (a) และ (b) มารวมกันโดยให้มีปริมาตรเท่าเดิม ทำให้มีแก๊ส H2 และ He มารวมอยู่ด้วยกัน แก๊สแต่ละชนิดยังคงมีความดันเท่าเดิม เรียกว่าความดันย่อย แต่เกิดขึ้นในภาชนะเดียวกันจึงนำมารวมกันเรียกว่าความดันรวม
Ptotaคือ ความดันรวมของแก๊สผสม
Ptotal = PH2 + PHe
(คลิ้ก ชมความดันย่อยของแก๊ส)
แบบฝึกหัด
1. The US Navy developed an undersea habitat whose atmosphere contains 79.0% He, 17.0% N2
and 4.0% O2 by volume. What is the partial pressure (atm) of oxygen when the habitat is 50.0 m
below sea level where the pressure is 5.91 atm? (Atomic weights: He = 4.00, N = 14.01, O =
16.00). (ans.d) (กองทัพเรืออเมริกันพัฒนาที่พักใต้ทะเลซึ่งจัดให้มีบรรยากาศที่ประกอบด้วย He 79.0%,
N2 17.0% และ O2 4.0% โดยปริมาตร จงหาความดันย่อยของออกซิเจน (atm) ที่ระดับความลึก 50.0
เมตร ความดัน 5.91 atm)
a) 4.0 b) 0.48 c) 1.2 d) 0.24 e) 2.4
2. A mixture of 3.65 g of CH2Cl2 and 1.50 g of CH4 is contained in a 50.0 mL container at 400oC.
What is the total pressure (atm) of the mixture? (Atomic weights: C = 12.01, Cl = 35.45, H =
1.008). (ans.d) (แก๊สผสมซึ่งประกอบด้วย CH2Cl2 3.65 g และ CH41.50 g บรรจุในภาชนะขนาด 50.0
mL อุณหภูมิ 400 oC ความดันรวมของแก๊สเป็นกี่ atm)
a) 103 b) 125 c) 55.0 d) 151 e) 47.5
3. A mixture of neon and argon is 25.0% neon by mass. What is the partial pressure (mm Hg) of
neon in the mixture at STP? (Atomic weights: Ne = 20.2, Ar = 39.95). (ans.d) (แก๊สผสมระหว่าง
นีออนกับอาร์กอน โดยส่วนที่เป็นนีออนมี 25.0 % โดยมวล ความดันย่อยของนีออนเป็นกี่ mmHg)
a) 460 b) 380 c) 250 d) 302 e) 520
4. แก๊สฮีเลียมบรรจุในถังขนาด 4 ลิตร ความดัน 2 atm ขณะเดียวกันแก๊สไฮโดรเจนบรรจุในถังขนาด 1 ลิตร
ความดันคงที่ค่าหนึ่ง มีท่อต่อถึงกัน เมื่อปล่อยให้แก๊สเข้ามาผสมกันโดยอุณหภูมิคงที่พบว่าความดันของ
แก๊สผสมเท่ากับ 1.8 atm จงหาความดันย่อยของแก๊สไฮโดรเจนว่าเป็นกี่ atm
1. 0.2 2. 1.0 3. 1.2 4. 1.6
5. ที่อุณหภูมิคงที่ แก๊ส A บรรจุอยู่ในถังขาด 1 ลิตร มีความดันค่าหนึ่ง ขณะที่แก๊ส B บรรจุในถังขนาด 3
ลิตร ความดัน 6 บรรยากาศ เมื่อต่อท่อให้แก๊สทั้งสองเข้าผสมกัน ความดันย่อยที่เกิดจากแก๊ส A เท่ากับ
0.5 บรรยากาศ จงคำนวณหาความดันรวมของแก๊สผสม
1. 5 บรรยากาศ 2. 6.5 บรรยากาศ 3. 8 บรรยากาศ 4. ข้อมูลไม่เพียงพอ
6. แก๊ส N2 บรรจุในถังขนาด 1 ลิตร ความดัน 0.5 บรรยากาศ ขณะที่แก๊ส H2 บรรจุในถังขนาด 2 ลิตร
ความดัน 3 บรรยากาศ ถ่ายแก๊สทั้งสองลงในถังอีกใบหนึ่งที่มีปริมาตร 5 ลิตร ความดันของแก๊สผสมจะ
เป็นกี่บรรยากาศเมื่ออุณหภูมิคงที่
1. 0.76 2. 1.30 3. 2.20 4. 2.58
7. ที่อุณหภูมิคงที่แก๊ส A บรรจุในถัง 1 ลิตร มีความดันค่าหนึ่ง ขณะที่แก๊ส B บรรจุในถังขนาด 3 ลิตร มี
ความดัน 4 บรรยากาศ ถ้าต่อท่อให้แก๊ส A และ B ผสมกันพบว่ามีความดันรวม 3.5 บรรยากาศ จงหา
ความดันย่อยของแก๊ส A ว่าเป็นกี่บรรยากาศ
1. 0.5 2. 1 3. 2 4. 4
8. บรรจุแก๊ส A ในภาชนะขนาด 6.2 dm3 ที่ความดัน 540 mmHg ที่อุณหภูมิ 37 oC แล้วนำแก๊ส B บรรจุ
ผสมลงไปในภาชนะเดียวกันโดยไม่เกิดปฏิกิริยาและอุณหภูมิคงที่ ทำให้มีความดันรวมเท่ากับ 692
mmHg จงหาว่าแก๊ส B ที่เติมลงไปมีปริมาตรกี่ cm3 ที่ STP
1. 670 2. 875 3. 1,092 4. 3,879
9. บรรจุแก๊สฮีเลียม 10 กรัม ในถังขนาด 5 dm3 ที่อุณหภูมิ 27 oC นำถังแก๊สดังกล่าวมาต่อท่อขนาดเล็ก
มากกับถังแก๊ส B ซึ่งมีปริมาตร 10 dm3 เปิดให้ผสมกันที่อุณหภูมิคงที่ ถ้าความดันรวมของแก๊สเท่ากับ
5.5 atm ความดันย่อยของแก๊ส B มีค่ากี่ atm
1. 1.4 2. 4.1 3. 5.5 4. 12.3
10. บรรจุแก๊ส A B และ C ชนิดละ 20 กรัม ลงในถังใบเดียวกัน ที่อุณหภูมิหนึ่ง ถ้ามวลโมเลกุลของแก๊สมี
ค่า 32 28 และ 16 ตามลำดับ ความดันย่อยของแก๊สทั้ง 3 ชนิดจะมีลำดับดังข้อใด
1. A>B>C 2. B>A>C 3. C>B>A 4. C>A>B
11. แก๊สฮีเลียมบรรจุในภาชนะขนาด 2 dm3 ความดัน 4 บรรยากาศ ในขณะที่แก๊สออกซิเจนบรรจุใน
ภาชนะขนาด 4 dm3 มีความดันค่าหนึ่ง เมื่อต่อท่อขนาดเล็กถึงกันระหว่างภาชนะ 2 ใบ ให้แก๊สทั้งสอง
ผสมกันโดยอุณหภูมิคงที่ ปรากฏว่าความดันย่อยของแก๊สออกซิเจนเท่ากับ 0.4 บรรยากาศ จง
คำนวณหาความดันรวมของแก๊สผสมว่าเป็นกี่บรรยากาศ
1. 0.6 2. 1.73 3. 2.4 4. 10.4
12. ที่อุณหภูมิ 0 oC แก๊ส CO2 จำนวน 2 โมล ผสมกับแก๊ส O2 จำนวนหนึ่งในภาชนะที่มีปริมาตร 8.96
ลิตร พบว่าแก๊สผสมมีความดันรวม 10 บรรยากาศ จงหาจำนวนโมลของแก๊ส O2
1. 2 โมล 2. 3 โมล 3. 4 โมล 4. 8 โมล
13. แก๊สผสมประกอบด้วย A2 B2 และ C2 ในอัตราส่วนจำนวนโมล 2:3:4 ตามลำดับ ในภาชนะซึ่งมีปริมาตร
16 dm3 อุณหภูมิ 273 oC ถ้าแก๊ส B2 มีความดันย่อยเป็น 25.2 atm จงหาความดันรวมของ A2 และ C2
1. 76.5 atm 2. 50.4 atm 3. 25.2 atm 4. 33.6 atm
14. แก๊ส A 3 โมล ผสมอยู่กับแก๊ส B 7 โมล ในถังเหล็กซึ่งมีปริมาตร 41 dm3 ที่อุณหภูมิ 27 oC โดยไม่
ทำปฏิกิริยากัน ถ้าถ่ายแก๊สผสมนี้ไปยังถังเปล่าใบหนึ่งปริมาตร 50 dm3 จนทำให้มีความดัน 2.46 atm
ที่อุณหภูมิเดียวกัน จงหาความดันของแก๊สผสมที่เหลือในถังเดิม
1. 1.5 atm 2. 2.54 atm 3. 3 atm 4. 6 atm
15. แก๊สผสมประกอบด้วย H2 0.2 mol N2 0.3 mol และ Ar 0.5 mol บรรจุอยู่ในถังใบหนึ่งที่ STP จงหา
ปริมาตรของถังใบดังกล่าวนี้
1. 22.4 dn3 2. 11.15 dm3 3. 6.09 dm3 4. 4.46 dm3
16. ถังใบหนึ่งมีปริมาตร 6 dm3 บรรจุแก๊สเอทิลีน (C2H4) จำนวนหนึ่งเอาไว้ จากนั้นใส่น้ำแข็งแห้งลงไป 4.4
กรัม เมื่อน้ำแข็งแห้งระเหิดกลายเป็นแก๊สจนหมด ปรากฏว่าความดันรวมของแก๊สในถังเป็น 1 atm ถ้า
อุณหภูมิของแก๊สเท่ากับ 27 oC จงหาความดันที่เกิดจากแก๊สเอทิลีนในถังนี้
1. 0.04 atm 2. 0.4 atm 3. 0.6 atm 4. 0.96 atm
17. (Pat.2 ก.ค.52) แก๊สชนิดหนึ่งหนัก 1.0 กรัม ที่ 12 องศาเซลเซียส ความดัน 1 บรรยากาศ มีปริมาตร 2.0 ลิตร ถ้าแก๊สชนิดนี้หนัก 2.0 กรัม ที่ 69 องศาเซลเซียส ความดัน 608
มิลลิเมตรปรอท จะมีปริมาตรเป็นกี่ลิตร
เพิ่มเติม
1. A gas mixture consists of 60.0% Ar, 30.0% Ne, and 10.0% Kr by volume. If the pressure of this gas mixture is 80.0 kPa, what is the partial pressure of each of the gases? ;
(แก๊สผสมซึ่งประกอบด้วย Ar 60.0 % Ne 30.0 % และ Kr 10.0 % โดยปริมาตร ถ้าแก๊สผสมนี้มีความดันรวม 80.0 kPa อยากทราบว่าแก๊สแต่ละชนิดมีความดันย่อยเท่าไร) ; Ar=40
Ne=20 Kr=84
2. The total pressure of a mixture of H2, He, and Ar is 99.3 kPa. The partial pressure of the He is 42.7 kPa, and the partial pressure of Ar is 54.7 kPa. What is the partial
pressure of hydrogen?
(แก๊สผสมซึ่งประกอบด้วย H2, He, และ Ar มีความดันรวม 99.3 kPa ถ้าความดันย่อยของ He = 42.7 kPa และความดันย่อยของ Ar = 54.7 kPa อยากทราบว่าความดันย่อยของ H2 เป็น
เท่าไร )
3. A cylinder contains 40 g of He, 56 g of N2, and 40 g of Ar. (กระบอกอันหนึ่งบรรจุแก๊ส He 40 กรัม N2 56 กรัม และ Ar 40 กรัม ) ; He=4 N=14 Ar=40
(a) How many moles of each gas are in the mixture? (แก๊สแต่ละชนิดมีจำนวนโมลเท่าไร)
(b) If the total pressure of the mixture is 10 atm, what is the partial pressure of He? (ถ้าความดัน
รวมของแก๊สคือ 10 atm อยากทราบว่าความดันย่อยของ He เป็นเท่าไร)
4. What is the partial pressure of each gas in a mixture which contains 40 g of He, 56 g of N2, and 16 g of O2, if the total pressure of the mixture is 5 atmospheres? (แก๊สผสม
ซึ่งประกอบด้วย He 40 กรัม N2 56 กรัม และ O2 56 กรัม อยากทราบว่าความดันรวมของแก๊สเป็นเท่าไร)
5. The composition of dry air by volume is 78.1% N2, 20.9% O2, and 1% other gases. Calculate the partial pressures, in atmospheres and kPa, in a tank of dry air compressed to
10.0 atmospheres. (อากาศแห้งซึ่งประกอบด้วย N278.1% O2 20.9%, และแก๊สอื่น ๆ 1% ถ้าอัดแก๊สจนมีความดัน 10 atm จงหาความดันย่อยของแก๊สในหน่วย atm และ kPa ) ; 1 atm
= 101 kPa
6. If a steel container holds 2.00 moles of hydrogen gas and 2.00 moles of helium gas, and the total
pressure is 4.00 atm., what is the partial pressure of each of the gases?
(ถังเหล็กใบหนึ่งบรรจุแก๊สไฮโดรเจนและแก๊สฮีเลียม ชนิดละ 2.00 โมล มีความดันรวม 4.00 atm
อยากทราบว่าความดันย่อยของแก๊สแต่ละชนิดเป็นเท่าไร)
7. If a steel container holds 1.00 moles of oxygen gas and 3.00 moles of argon gas and the total
pressure is 800 Torr, what is the partialpressure of each of the gases?
(ถังเหล็กใบหนึ่งบรรจุแก๊สออกซิเจน 1.00 โมล และแก๊สอาร์กอน 3.00 โมล มีความดันรวม 800 Torr
อยากทราบว่าความดันย่อยของแก๊สแต่ละชนิดเป็นเท่าไร)
8. If a steel container holds 1.50 moles of nitrogen gas and 2.50 moles of helium gas at a total
pressure of 760 mm Hg, what is the partial pressure of each of the gases?
9. A rigid container with a volume of 5.60 l holds 71.0g chlorine gas and 4.00g helium gas. If the
total pressure is 760 mm Hg what is the partial pressure of both gases? (ถังขนาดเล็กใบหนึ่งมี
ปริมาตร 5.60 ลิตร บรรจุแก๊สคลอรีน 71.0 กรัม และฮีเลียม 4.00 กรัม ถ้าความดันรวมของแก๊สในถัง
คือ 760 mm Hg อยากทราบว่าความดันย่อยของแก๊สแต่ละชนิดเป็นเท่าไร)
10. A 22.4 liter glass bulb has a total pressure of 760 Torr at 0.0˚C and contains three different
gases, nitrogen, helium and argon. If the partial pressure of nitrogen is 250 Torr and the partial
pressure of argon is 130 Torr, what is the number of moles of helium in the tank? (ถังบรรจุแก๊สมี
ปริมาตร 22.0 ลิตร บรรจุแก๊สเอาไว้ 3 ชนิด คือ ไนโตรเจน ฮีเลียมและอาร์กอน มีความดันรวม 760
Torr ที่อุณหภูมิ 0.0˚C ถ้าความดันย่อยของไนโตรเจนคือ 250 Torr และความดันย่อยของอาร์กอนคือ
130 Torr อยากทราบว่าจำนวนโมลของฮีเลียมเป็นเท่าไร)
รูปภาพที่เกี่ยวข้อง

Size : 59.34 KBs
Upload : 2014-02-14 04:44:40
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|