ของแข็ง ของเหลว แก๊ส (ตอนที่ 3) สมบัติของของเหลว
สมบัติของของเหลว
เมื่อพิจารณาสมบัติสารใดสารหนึ่งที่อยู่ต่างสถานะกันเรากล่าวได้ว่า ขณะที่เป็นของเหลวของเหลวอนุภาคจะมีพลังงานจลน์มากกว่าเมื่อเป็นของแข็ง ทำให้อนุภาคเคลื่อนที่ไปมาได้ จึงมีรูปร่างไม่แน่นอน เปลี่ยนแปลงไปตามภาชนะที่บรรจุ แต่อนุภาคอยู่ชิดกันมากจึงมีปริมาตรคงที่ ของเหลวแต่ละชนิดมีสมบัติเฉพาะตัว ดังนี้
5.5.1 ความตึงผิวหรือแรงตึงผิว (surface tension)
คือ แรงต้านที่ผิวหน้าของของเหลวทำให้มีสมบัติคล้ายมีแผ่นฟีล์มบาง ๆ ปิดอยู่บนผิวหน้า (surface film) ทำให้แมลงตัวเบา ๆ เช่น จิงโจ้น้ำ สามารถเกาะอยู่บนผิวน้ำได้โดยไม่จม รวมทั้งวัตถุบางอย่างที่ปกติจะจมในของเหลวก็สามารถลายอยู่ได้ ถ้าวัตถุดังกล่าวไม่หนักมากจนเกินไป สมบัตินี้เกิดจากแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว ของเหลวชนิดใดมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากก็จะมีแรงตึงผิวมาก ของเหลวต่างชนิดจึงมีแรงตึงผิวไม่เท่ากัน แรงตึงผิวของของเหลวจะทำให้ของเหลวมีรูปร่างเป็นทรงกลมเมื่อลอยตัวอย่างอิสระ ของเหลวที่มีแรงตึงผิวมากก็จะเกิดรูปทรงกลมได้เร็ว เมื่อหยดอยู่บนพื้นที่ผิวเป็นมันของเหลวที่มีแรงตึงผิวมากจำมีรูปทรงเป็นครึ่งวงกลมชัดเจนกว่าชนิดที่มีแรงตึงผิวน้อย
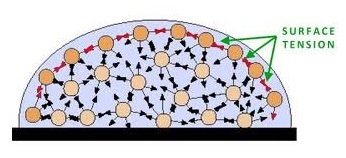 
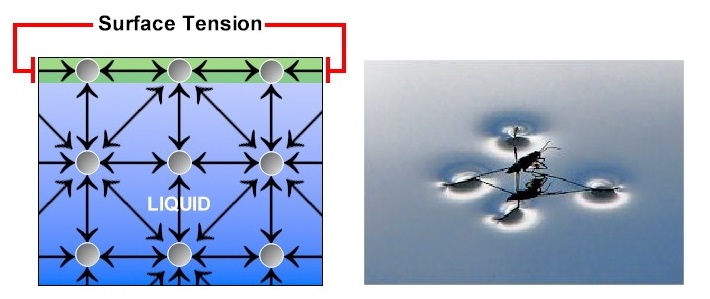


(คลิ้กอ่านเพิ่มเติมความตึงผิวหรือแรงตึงผิว)
แต่อย่างไรก็ตามสารบางอย่างสามารถลดความตึงผิวได้ เช่น ผงซักฟอกหรือสารที่ใช้ในการซักล้างต่าง ๆ เมื่อผสมน้ำก็จะไปแทรกตัวอยู่ระหว่างโมเลกุลของน้ำทำให้แรงดึงดูดระหว่างโมเลกุลของน้ำลดลง สำหรับน้ำมันเป็นของเหลวที่มีแรงตึงผิวต่ำ ฉะนั้นเมื่อมีคราบน้ำมันอยู่บนผิวน้ำจิงโจ้น้ำจะจม
ชมวีดีทัศน์แสดงสมบัติของความตึงผิว 1 ชมวีดีทัศน์แสดงการทดลองสมบัติของความตึงผิว 2
การระเหย (Evaporation ,Vaperization)
หมายถึงการที่ของเหลวเปลี่ยนสถานะไปเป็นไอ ของเหลวสามารถระเหยได้แม้อุณหภูมิจะยังไม่ถึงจุดเดือด แต่เกิดขึ้นเฉพาะบริเวณผิวหน้าของของเหลวเท่านั้น การจัดเรียงอนุภาคในของเหลวจะไม่เป็นระเบียบ โมเลกุลของของเหลวเคลื่อนที่ได้ มีช่องว่างอยู่ระหว่างโมเลกุลน้อยมาก จึงชนกันเองหรือชนกับผนังภาชนะอยู่ตลอดเวลา ผลของการชนจะมีการถ่ายโอนพลังงานให้แก่กันและกัน ทำให้บางโมเลกุลของของเหลวมีพลังงานจลน์เพิ่มขึ้น และบางโมเลกุลมีพลังงานจลน์ลดลง ถ้าโมเลกุลที่อยู่บริเวณผิวหน้าของของเหลวมีพลังงานจลน์เพิ่มขึ้นจนถึงระดับที่มากกว่าแรงยึดเหนี่ยวระหว่างโมเลกุลที่อยู่ข้างเคียง โมเลกุลเหล่านั้นจะหลุดออกจากผิวหน้าของของเหลวกลายเป็นไอ การที่ของเหลวเปลี่ยนสถานะไปเป็นไอโดยที่อุณหภูมิยังไม่ถึงจุดเดือดนี้เรียกว่าการระเหย จะเกิดขึ้นบริเวณผิวหน้าของของเหลวเท่านั้น ปัจจัยที่มีผลต่อการระเหยได้แก่
1. ความชื้นในอากาศ ถ้าอากาศมีความชื้นมากการระเหยจะช้า
2. พื้นที่ผิวของของเหลว ถ้ามีพื้นที่ผิวมากการระเหยจะเร็วขึ้น
3. อุณหภูมิ โดยทั่วไปแล้วเมื่ออุณหภูมิเพิ่มขึ้นการระเหยจะเร็วขึ้น
4. การถ่ายเทของอากาศ ถาอากาศถ่ายเทได้ดีหรือมีลมพัด จะช่วยให้การระเหยเกิดได้เร็วขึ้น
ขณะที่ของเหลวระเหยจะดูดพลังงานความร้อนส่วนหนึ่งไปจากของเหลวติดไปกับไอที่ระเหยไป ทำให้ของเหลวส่วนที่เหลือมีอุณหภูมิของลดลง ความร้อนที่ใช้ในการระเหยของของเหลวเรียกว่าความร้อนแฝงของการกลายเป็นไอ (Latent Heat Vaporization ) ใช้หน่วยเป็นแคลอรี/กรัม หรือจูล/กรัม ของเหลวที่ระเหยง่ายจะใช้ความร้อนน้อยจึงมีความร้อนแฝงของการกลายเป็นไอต่ำ บรรดาเครื่องทำความเย็นต่าง ๆ เช่น ตู้เย็น เครื่องปรับอากาศ ต่างก็ใช้หลักการระเหยของของเหลวทั้งสิ้น (ให้ทำความเข้าใจว่าเครื่องทำความเย็นไม่ได้ผลิตความเย็น แต่ทำหน้าที่ดูดความร้อนจากวัตถุออกไป การที่วัตถุเสียความร้อนจะทำให้อุณหภูมิของวัตถุลดลง จึงรู้สึกว่าเย็น )
การระเหยที่เกิดขึ้นเมื่อของเหลวเดือดจะเกิดขึ้นได้พร้อมกันทั่วทุกส่วน ถ้าเราสังเกตน้ำเดือดจะเห็นว่ามีฟองเกิดขึ้นทั่วไป ฟองที่เห็นก็คือฟองของไอน้ำ เป็นส่วนที่ต่างวัฏภาคกับน้ำที่ยังเป็นของเหลว จึงแยกส่วนกัน แต่มีอุณหภูมิเท่ากัน คืออุณหภูมิเท่ากับจุดเดือดของของเหลวนั้น แต่มีพลังงานจลน์ไม่เท่ากัน ส่วนที่เป็นน้ำเดือดมีพลังงานจลน์ต่ำกว่าส่วนที่เป็นไอ ขณะที่ของเหลวกำลังเดือดจะมีอุณหภูมิคงที่ เหตุผลเป็นทำนองเดียวกับการหลอมเหลว (หน้า 12)
ตัวอย่าง ความร้อนแฝงของการกลายเป็นไอและจุดเดือดของของเหลวบางชนิด
|
Substance
|
Latent Heat
VaporizationkJ/kg
|
Boiling Point
°C
|
|
Water
|
2,260
|
100
|
|
Ammonia
|
1,369
|
−33.34
|
|
Lead
|
871
|
1750
|
|
Alcohol, ethyl
|
855
|
78.3
|
|
Carbon dioxide
|
574
|
−57
|
|
Hydrogen(2)
|
455
|
−253
|
|
Toluene
|
351
|
110.6
|
|
R134a
|
2,15.9
|
−26.6
|
(คลิ้ก ชมการระเหยและปัจจัยที่มีผลต่อการระเหย)
(คลิ้ก ชมแสดงความร้อนแฝงของการกลายหลอมเหลวและการกลายเป็นเป็นไอ)
(คลิกชมแสดงพลังงานของอนุภาคทุกสถานะ)
(คลิ้ก ฟังเพลงแห่งการเปลี่ยนสถานะของน้ำ)
ความดันไอกับจุดเดือดของของเหลว
เมื่อบรรจุของเหลวในภาชนะปิด ณ อุณหภูมิหนึ่งโดยบรรจุไม่เต็ม โมเลกุลของของเหลวที่ระเหยกลายเป็นไอจะอยู่ในที่ว่างเหนือของเหลว ดังรูป

โมเลกุลที่อยู่ในรูปของไอจะเคลื่อนที่อยู่ตลอดเวลาเพราะมีพลังงานจลน์มาก เมื่อชนผนังภาชนะจะทำให้เกิดความดันเรียกว่าความดันไอ (vapor pressure) (คลิ้ก ชมการเกิดความดันไอ) ความดันไอจะแปรผันตรงกับอุณหภูมิ เนื่องจากเมื่ออุณหภูมิสูงขึ้นการระเหยก็จะเกิดได้ดีขึ้น ทำให้มีความหนาแน่นของไอเพิ่มขึ้น ขณะเดียวกันพลังงานจลน์ของไอก็เพิ่มขึ้นด้วย ทำให้ความถี่ในการชนและพลังงานที่เกิดจากการชนมากขึ้น ความดันจึงเพิ่มขึ้น (คลิ้ก ชมการอธิบายเรื่องความดันไอ) (คลิ้ก ชมการแสดงความดันไอกับอุณหภูมิ) เมื่ออุณหภูมิคงที่อัตราเร็วในการระเหยจะคงที่ ไอของของเหลวสามารถควบแน่นกลับมาเป็นของเหลวได้อีก ถ้าอัตราเร็วในการระเหยเท่ากับอัตราเร็วในการควบแน่น จะเรียกว่าระบบเข้าสู่ภาวะสมดุล เป็นภาวะสมดุลระหว่างสถานะ ขณะที่อยู่ในภาวะสมดุลความดันไอของของเหลวจะคงที่ (คลิ้ก ชมอัตราเร็วในการระเหยกับอัตราเร็วในการควบแน่น)
ถ้าเปรียบเทียบระหว่างของเหลวต่างชนิดที่อุณหภูมิเดียวกัน ของเหลวที่ระเหยง่ายจะมีความดันไอสูงกว่าของเหลวที่ระเหยยาก ความดันไอของของเหลวต่าง ๆ จะสัมพันธ์กับจุดเดือดของของเหลวนั้น ๆ ในลักษณะของการแปรผกผัน คือถ้าความดันไอสูงจุดเดือดจะต่ำ เหตุผลคือขณะที่ของเหลวเดือดความดันไอของของเหลวจะเท่ากับความดันบรรยากาศที่กดลงบนผิวหน้าของเหลวในขณะนั้น ฉะนั้นของเหลวที่ระเหยง่ายจึงมีจุดเดือดต่ำกว่าของเหลวที่ระเหยยาก เพราะของเหลวที่ระเหยง่ายจะเป็นไอได้ง่ายโดยไม่ต้องใช้ความร้อนสูง โอกาสที่ความดันไอจะเท่ากับความดันบรรยากาศที่กดลงบนผิวหน้าจึงเกิดได้เร็วที่อุณหภูมิต่ำ ต่างจากของเหลวที่ระเหยยากที่ต้องใช้ความร้อนสูงเพื่อให้เกิดการระเหย จนมีไอมากพอที่จะทำให้มีความดันไอเท่ากับความดันบรรยากาศ นอกจากนั้นแล้วของเหลวชนิดเดียวกันจะมีจุดเดือดเปลี่ยนแปลงได้เมื่อความดันบรรยากาศบนผิวหน้าของเหลวเปลี่ยนไป เรียกจุดเดือดของของเหลวที่ความดัน 1.00 บรรยากาศว่าจุดเดือดปกติ (normal boiling point) เช่น จุดเดือดปกติของน้ำ คือ 100 oC แต่ถ้าความดันเพิ่มขึ้นจุดเดือดก็จะเพิ่มขึ้นด้วย ดังกราฟที่แสดงต่อไปนี้

จากกราฟเป็นการแสดงความสัมพันธ์ระหว่างความดันไอกับจุดเดือดของของเหลว 3 ชนิด คือ ไดเอทิลอีเทอร์ เอทานอลและน้ำ ลำดับของจุดเดือดคือ ไดเอทิลอีเทอร์ < เอทานอล < น้ำ แต่ลำดับของความดันไอคือ ไดเอทิลอีเทอร์ > เอทานอล > น้ำ แสดงว่าสารที่มีความดันไดสูงจะมีจะเดือดต่ำ จุดเดือดที่แสดงในกราฟ เป็นจุดเดือดที่ความดัน 760 torr หรือ 1 atm จึงเป็นจุดเดือดปกติของสารทั้ง 3 ชนิด
แต่อย่างไรก็ตามทุกจุดบนเส้นกราฟของแต่ละสาร ก็เป็นจุดเดือดของสารนั้น ๆ เช่นกัน แต่ไม่ใช่จุดเดือดปกติ เช่น ที่ความดัน 300 torr ถ้าลากเส้นขนานไปกับแกนนอนซึ่งแสดงอุณหภูมิ จุดตัดระหว่างเส้นที่ลากกับเส้นกราฟของสาร ก็คือจุดเดือดของสารเหล่านั้นเช่นกัน แต่ไม่ใช่จุดเดือดปกติ ดังแสดงในกราฟต่อไปนี้ จะเห็นได้ว่าที่ความดัน 300 torr จุดเดือดของแต่ละสารจะต่ำกว่าจุดเดือดปกติของสารนั้น ๆ

ในทางตรงกันข้ามถ้าเราเพิ่มความดันให้สูงกว่า 760 torr หรือ 1 atm จุดเดือดของของเหลวก็จะสูงกว่าจุดเดือดปกติ การทำให้ปลอดเชื้อด้วยหม้อนึ่งอัดความดันไอ (autoclave)
เมื่อฝาหม้อปิดสนิท ไอน้ำย่อมถูกเก็บสะสมเอาไว้มากขึ้นตามลำดับ ทำให้ความดันบนผิวหน้าของของน้ำเพิ่มขึ้น จุดเดือดจึงเพิ่มขึ้น พบว่าที่ความดัน 15 ปอนด์/ตารางนิ้ว (15 psi) จะมีจุดเดือดเท่ากับ
121 oC จุลินทรีย์ทุกชนิดจะตายที่อุณหภูมินี้ ทำให้สิ่งต่าง ๆ ที่ผ่านการนึ่งหรืออบด้วย autoclave อย่างถูกวิธี จะเป็นวัตถุปลอดเชื้อ (streilisation) เช่น เครื่องมือแพทย์ อาหารสังเคราะห์ที่ใช้
เพาะเลี้ยงเนื้อเยื่อพืช อาหารกระป๋อง


หม้อนึ่งอัดความดันไอ (autoclave)
(ชมวีดีทัศน์แสดงวิธีใช้ autoclave)
หมายเหตุ
1 บาร์ = 100,000 ปาสกาล (Pa) = 100 กิโลปาสกาล (ปาสกาลคือหน่วยนิวตันต่อตารางเมตร)
1 บาร์ ≈ 0.98692 ความดันบรรยากาศ (atm)
1 บาร์ ≈ 14.5037744 ปอนด์ต่อตารางนิ้ว (psi)
แบบฝึกหัด
1. (Ent.43 ต.ค.) ปัจจัยใดต่อไปนี้มีผลต่อความดันไอของของเหลว
ก. แรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว
ข. ปริมาณของของเหลวซึ่งมีสมดุลระหว่างของเหลวและไอ
ค. อุณหภูมิของของเหลว
1. ก 2. ก ข 3. ก ค 4. ก ข ค
2. (Ent.44 ต.ค.) จากกราฟความดันไอของสารต่อไปนี้

ข้อสรุปใดถูกต้อง
1. ที่อุณหภูมิ 30 oC สาร C มีความดันไอต่ำสุด
2. สาร A และ B มีจุดเดือดเท่ากัน ณ ความดันบางค่า
3. สาร B มีแรงยึดเหนี่ยวระหว่างโมเลกุลสูงที่สุด
4. ไม่มีข้อใดถูก
3. (Ent.46 มี.ค.) กำหนดค่าความดันไอของของเหลว A และ B ที่อุณหภูมิ 30oC และ 80 oC ดังนี้
|
อุณหภูมิ (oC)
|
ความดันไอ (atm)
|
|
ของเหลว A
|
ของเหลว B
|
|
30
|
0.2
|
0.3
|
|
80
|
0.4
|
0.7
|
ข้อสรุปใดถูก
ก. ของเหลว B เดือดที่อุณหภูมิต่ำกว่าของเหลว A
ข. ความร้อนแฝงของการกลายเป็นไอของของเหลว B < ของเหลว B
ค. แรงดึงดูดระหว่างโมเลกุลของ B < แรงดึงดูดระหว่างโมเลกุลของ A
ง. มวลโมเลกุลของ B < มวลโมเลกุลของ A
1. ก ข 2. ก ข ค 3. ก ข ง 4. ก ข ค ง
3. (Ent.46 ต.ค.) พิจารณากราฟแสดงความสัมพันธ์ระหว่างความดันไอกับอุณหภูมิของของเหลว A และ B ต่อไปนี้

ข้อใดผิด
1. ความดันไอของของเหลว A และ B เพิ่มขึ้นตามอุณหภูมิ
2. ของเหลว B มีความดันไอสูงกว่าของเหลว A ที่อุณหภูมิ 80 oC
3. ของเหลว A มีจุดเดือดปกติสูงกว่าของเหลว B
4. ของเหลว A มีจุดเดือดปกติใกล้เคียงกับ 90 oC
4. (A-net 49 ) จากกราฟแสดงความสัมพันธ์ของความดันไอของของเหลว A B และ C กับอุณหภูมิ ดังรูป
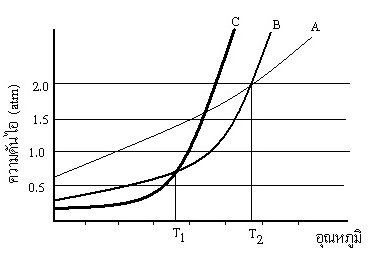
ข้อสรุปใดถูกต้อง
1. ของเหลวผสม A B และ C จะมีจุดเดือดปกติที่ครึ่งหนึ่งของ T1 และ T2
2. ที่ความดันบรรยากาศเท่ากับ 1.5 atm ของเหลว A และ B มีจุดเดือดเท่ากัน
3. ที่ความดันบรรยากาศสูงกว่า 1 atm ของเหลว A มีจุดเดือดต่ำที่สุด
4. ที่ความดันบรรยากาศต่ำกว่า 1 atm ของเหลวผสม C กับ B จะมีจุดเดือดต่ำกว่าจุดเดือดของสาร A ที่ความดันเดียวกัน
5. (A-net 50 ) ทดลองต้มของเหลว A แบบ ก และ ข โดยที่การทดลอง ก เป็นต้มแบบเปิดฝา ส่วนแบบ ข เป็นแบบปิดฝา ดังรูป ข้อความใดต่อไปนี้ถูกต้อง

1. จุดเดือดของของเหลว A จากการทดลอง ก สูงกว่าการทดลอง ข
2. จุดเดือดของของเหลว A จากการทดลอง ก เท่ากับการทดลอง ข
3. เมื่อให้ความร้อนเท่ากัน ของเหลว A ในการทดลอง ก จะเดือดก่อนการทดลอง ข
4. ขณะที่ของเหลว A เดือด ความดันไอของของเหลว A จากการทดลอง ก มีค่าสูงกว่าการทดลอง
6. (เคมีโอลิมปิครอบคัดเลือก 43) สาร P Q R และ S มีมวลโมเลกุลและจุดเดือดตามที่กำหนดให้
|
สาร
|
มวลโมเลกุล
|
จุดเดือด (oC)
|
|
P
|
p
|
110.0
|
|
Q
|
q
|
78.5
|
|
R
|
r
|
20.0
|
|
S
|
s
|
61.3
|
ข้อสรุปใดถูกต้องมากที่สุด
- สารทั้ง 4 ชนิด เป็นของเหลวที่อุณหภูมิห้อง
- p>q>s>r
- P มีความดันไอสูงที่สุด
- แรงดึงดูดระหว่างโมเลกุล P>Q>S>R
7. (เคมีโอลิมปิครอบคัดเลือก 43) ถ้าแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว A มีค่ามากกว่าแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว B สมบัติข้อใดต่อไปนี้ที่ของเหลว A
มีค่าน้อยกว่าของเหลว B
1. จุดเดือดปกติ
2. อุณหภูมิที่ทำให้ของเหลวมีความดันเท่ากับ 100 mmHg
3. ความร้อนของการกลายเป็นไอ
4. ความดันไอที่อุณหภูมิห้อง
8. (เคมีโอลิมปิครอบคัดเลือก 45) สมบัติข้อใดต่อไปนี้ที่ไม่ได้แสดงว่าสารมีแรงระหว่างโมเลกุลสูง
1. ความร้อนของการกลายเป็นไอสูง 2. ความหนืดสูง
3. ความดันไอสูง 4. อุณหภูมิจุดวิกฤติสูง
9. (เคมีโอลิมปิครอบคัดเลือก 46) ความดันไอของของเหลวในภาชนะจะมีการเปลี่ยนแปลงอย่างไร เมื่อเพิ่มปริมาตรของของเหลวเป็น 2 เท่า ที่อุณหภูมิคงที่
1. เพิ่มขึ้น 2. ลดลง
3. คงเดิม 4. อาจเพิ่มขึ้นหรือลดลงขึ้นอยู่กับชนิดของของเหลว
10. (เคมีโอลิมปิครอบคัดเลือก 47) ภาชนะบรรจุปรอท มีหลอดแก้วปลายปิดความสูงเท่ากัน 2 หลอดคว่ำอยู่ในภาชนะ ถ้าฉีดน้ำบริสุทธิ์ (H2O) และเอทานอลบริสุทธิ์ ด้วยปริมาตรที่เท่ากัน
ผ่านเข้าไปในหลอดแก้วดังรูป เมื่อเวลาผ่านไปที่อุณหภูมิห้อง ผลการทดลองที่คาดว่าจะสังเกตได้ตรงตามข้อใด
กำหนดให้ความตึงผิวของน้ำและเอทานอลเท่ากับ 0.0720 และ 0.0220 N/m ตามลำดับ

- ระดับปรอทในหลอดแก้วทั้งสองเท่ากัน
2. ระดับปรอทในหลอดแก้วด้านที่บรรจุน้ำสูงกว่าด้านที่บรรจุเอทานอล
3. ระดับปรอทในหลอดแก้วที่บรรจุน้ำต่ำกว่าด้านที่บรรจุเอทานอล
4. ยังสรุปไม่ได้
11. Indicate the strongest IMF (Inter Molucular Force) holding together crystals of the following: (จงระบุชนิดของแรงยึดเหนี่ยวระหว่างอนุภาคชนิดที่มีความแรงที่สุดในสารต่าง ๆ ต่อไปนี้)
|
|
|
Molecular Crystal
|
Metal
|
Ionic Crystal
|
Network Solid
|
|
|
|
London
forces
|
Dipole-dipole attractions
|
Hydrogen Bonds
|
Metallic Bonds
|
Ionic
Bonds
|
Covalent Bonds
|
|
1.
|
NH3
|
|
|
|
|
|
|
|
2.
|
Kr
|
|
|
|
|
|
|
|
3.
|
HCl
|
|
|
|
|
|
|
|
4.
|
F2
|
|
|
|
|
|
|
|
5.
|
KMnO4
|
|
|
|
|
|
|
|
6.
|
NaCl
|
|
|
|
|
|
|
|
7.
|
SO2
|
|
|
|
|
|
|
|
8.
|
CO2
|
|
|
|
|
|
|
|
9.
|
C3H8
|
|
|
|
|
|
|
|
10.
|
CH4
|
|
|
|
|
|
|
|
11.
|
CH3Cl
|
|
|
|
|
|
|
|
12.
|
HF
|
|
|
|
|
|
|
|
13.
|
C6H6
|
|
|
|
|
|
|
|
14.
|
NO
|
|
|
|
|
|
|
|
15.
|
H2SO4
|
|
|
|
|
|
|
|
16.
|
WC
|
|
|
|
|
|
|
|
17.
|
Si
|
|
|
|
|
|
|
|
18.
|
SiO2
|
|
|
|
|
|
|
|
19.
|
C(graphite)
|
|
|
|
|
|
|
|
20.
|
N2
|
|
|
|
|
|
|
|
21.
|
CH3OH
|
|
|
|
|
|
|
|
22.
|
Ag
|
|
|
|
|
|
|
|
23.
|
(C2H5)2NH
|
|
|
|
|
|
|
|
24.
|
NaOH
|
|
|
|
|
|
|
|
25.
|
Al
|
|
|
|
|
|
|
|
26.
|
PCl3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Molecular Crystal
|
Metal
|
Ionic Crystal
|
Network Solid
|
|
|
|
London
forces
|
Dipole-dipole attractions
|
Hydrogen Bonds
|
Metallic Bonds
|
Ionic
Bonds
|
Covalent Bonds
|
|
27.
|
XeF4
|
|
|
|
|
|
|
|
28.
|
He
|
|
|
|
|
|
|
|
29.
|
Na
|
|
|
|
|
|
|
|
30.
|
CO
|
|
|
|
|
|
|
|
31.
|
Ar
|
|
|
|
|
|
|
|
32.
|
Ba(OH)2
|
|
|
|
|
|
|
|
33.
|
O2
|
|
|
|
|
|
|
|
34.
|
H2O
|
|
|
|
|
|
|
|
35.
|
NH4Cl
|
|
|
|
|
|
|
|
36.
|
Hg
|
|
|
|
|
|
|
|
37.
|
P4
|
|
|
|
|
|
|
|
|

Size : 27.45 KBs
Upload : 2014-02-12 20:12:51
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|