พันธะเคมี ตอนที่ 9 สภาพขั้วของโมเลกุลโคเวเลนต์และแรงยึดเหนี่บวระหว่างโมเลกุล
สภาพขั้วของพันธะโคเวเลนต์
โมเลกุลโคเวเลนต์ประกอบขึ้นด้วยพันธะโคเวเลนต์ระหว่าง อะตอมของธาตุต่าง ๆ ที่ประกอบกันขึ้นเป็นโมเลกุลของสารโคเวเลนต์นั้น
ๆ
พันธะโคเวเลนต์อาจเกิดขึ้นระหว่างอะตอมของธาตุเดียวกัน หรืออะตอมของธาตุต่างชนิดกันก็ได้ โดยธาตุแต่ละธาตุจะมีค่า EN เป็นค่าเฉพาะตัวซึ่งไม่เท่ากัน ค่า EN แสดงความสามารถในการดึงดูดอิเล็กตรอนของแต่ละธาตุ ถ้าพันธะโคเวเลนต์เกิดจากธาตุเดียวกันสร้างพันธะกัน เช่น H2 F2
Cl2 Br2 I2 O2
N2 P4 S8
C60 (หรืออาจเป็นธาตุต่างชนิดแต่มีค่า EN
ต่างกันน้อยกว่า
0.4) อิเล็กตรอนคู่ร่วมพันธะก็จะมีโอกาสโคจรไปยังอะตอมทั้งคู่โดยเท่าเทียมกัน
จึงไม่เกิดความแตกต่างของขั้วไฟฟ้าระหว่างอะตอมทั้งคู่ที่สร้างพันธะกันนั้น เราเรียกพันธะในลักษณะนี้ว่าพันธะไม่มีขั้ว
(non-polar
bond) แต่ถ้าอะตอมที่สร้างพันธะกันมีค่า EN ต่างกันระหว่าง 0.4
ถึง 1.7 จะเป็นพันธะโคเวเลนต์ชนิดมีขั้ว (polar covalemt
bond) และถ้ามีค่า EN ต่างกันมากกว่า 1.7
จะเป็นพันธะไอออนิก ค่าอิเล็กโตรเนกาติวิตีของธาตุต่าง
ๆ เป็นดังนี้
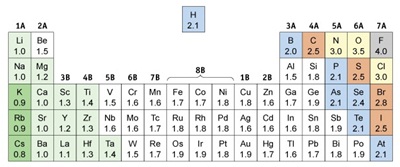
ถ้าใช้ความแตกต่างของค่าอิเล็กโตรเนกาติวิตี (EN) ของธาตุที่สร้างพันธะกัน เป็นเกณฑ์ในการในการจำแนกสมบัติของพันธะแล้ว จะเป็นดังนี้

จากตารางและข้อมูลประกอบแสดงว่า จากความแตกต่างของค่า EN ของธาตุที่สร้างพันธะกัน ทำให้จำแนกพันธะออกเป็น 3
พวก คือ
1. ค่า EN ต่างกันน้อยกว่า 0.4
เป็นพันธะโคเวเลนต์ชนิดไม่มีขั้ว (Non-polar
covalent bond)
2. ค่า EN ต่างกันมากกว่า 0.4
แต่น้อยกว่า 1.7 เป็นพันธะโคเวเลนต์ชนิดมีขั้ว (Polar-covalent bond)
3. ค่า EN ต่างกันมากกว่า 1.7 เป็นพันธะไอออนิก (Ionic bond)
นอกจากนั้นค่า EN
ที่แตกต่างกันยังแสดงถึงความเป็นไอออนิกหรือความเป็นโคเวเลนต์ที่ไม่เท่ากันด้วย ดูได้จาก Percent
ionic และ Percent
covalent ซึ่งจะเห็นได้ว่าสมบัติ
2 ด้านนี้จะตรงข้ามกัน เพื่อให้เกิดความเข้าใจที่ถูกต้องยิ่งขึ้น จงแสดงสมบัติต่าง ๆ ของธาตุตามที่กำหนดลงในตาราง
Percentage Ionic character
|
Bonding
between
(พันธะระหว่าง)
|
More
electronegative
element and value
(ธาตุที่มีค่า EN มากกว่าคือธาตุอะไรและมีค่า EN เท่าไร)
|
Less
electronegative
element and value
(ธาตุที่มีค่า EN น้อยกว่าคือธาตุอะไรและมีค่า EN เท่าไร)
|
Difference
in electronegativity
(ค่า EN ต่างกันเท่าไร)
|
Bond
Type
(เป็นพันธะชนิดใด)
|
|
Sulfur and
Hydrogen
|
|
|
|
|
|
Sulfur and
cesium
|
|
|
|
|
|
Chlorine and
bromine
|
|
|
|
|
|
Calcium and
chlorine
|
|
|
|
|
|
Oxygen and
hydrogen
|
|
|
|
|
|
Nitrogen and
hydrogen
|
|
|
|
|
|
Iodine and
iodine
|
|
|
|
|
|
Copper and
sulfur
|
|
|
|
|
|
Hydrogen and
fluorine
|
|
|
|
|
|
Carbon and
oxygen
|
|
|
|
|
พันธะไม่มีขั้ว (Non polar covalent bond)
พันธะไม่มีขั้วอย่างแท้จริงต้องเกิดจากการที่ธาตุเดียวกันสร้างพันธะกัน เพราะมีค่า EN เท่ากัน
ทำให้อิเล็กตรอนคู่ร่วมพันธะมีโอกาสโคจรอยู่ระหว่างอะตอมทั้งสองเท่ากัน จึงไม่เกิดความแตกต่างของขั้วไฟฟ้า จึงเป็นพันะไม่มีขั้ว ดังรูป

แต่อย่างไรก็ตามแม้บางครั้งจะเป็นการสร้างพันธะของธาตุต่างชนิด แต่ค่า EN ใกล้เคียงกัน
ต่างกันน้อยกว่า 0.4 ก็ยังอนุโลมว่าเป็นพันธะไม่มีขั้ว แต่ไม่แท้จริง
เพราะความจริงมีขั้วเล็กน้อยแต่ไม่แสดงความมีขั้วที่ชัดเจน
(คลิก ชมลักษณะของการเกิดพันธะโคเวเลนต์ไม่มีขั้ว)
พันธะมีขั้ว (Polar
covalent bond)
เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมของธาตุต่างชนิด ซึ่งมีค่า EN ต่างกันตั้งแต่ 0.4 แต่น้อยกว่า 1.7
อะตอมที่มีค่า EN
มากกว่าจะดึงดูดอิเล็กตรอนคู่ร่วมพันธะไปได้มากกว่า ทำให้ความหนาแน่นของอิเล็กตรอนทางด้านตะตอมที่มีค่า EN มาก
มีมากกว่าทางด้านอะตอมที่มีค่า
EN น้อย จึงทำให้แสดงขั้วลบขึ้นมาเล็กน้อย เขียนแสดงด้วยเครื่องหมาย (อ่านว่า เดลต้าลบ) ในขณะที่ทางด้านอะตอมที่มีค่า EN น้อยกว่า
จะแสดงขั้วบวกขึ้นมาเล็กน้ย เขียนเช่นกัน แสดงด้วยเครื่งหมาย (อ่านว่า เดลต้าบวก) ดังรูป
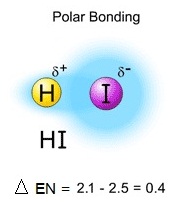
(คลิ้ก ชมลักษณะของการเกิดพันธะโคเวเลนต์มีขั้ว)
การเขียนแสดงขั้วของพันธะให้เขียนเครื่องหมาย
ไว้ทางด้านอะตอมที่มีค่า EN สูงกว่า และเขียนเครื่องหมาย เอาไว้ทางด้านอะตอมที่มีค่า EN ต่ำกว่า
แต่ความแรงของขั้วลบและขั้วบวกของพันธะ
ความแรงจะไม่เท่าไอออนบวกหรือไอออนลบ
เพราะขั้วของพันธะเกิดจากอะตอมที่มีค่า EN สูงกว่าดึงดูดอิเล็กตรอนคู่ร่วมพันธะไปได้มากกว่าเท่านั้น แต่ไม่ได้อิเล็กตรอนดังกล่าวไปโดยสมบูรณ์
ต่างจากกรณีของไอออนที่เกิดจากการถ่ายเทอิเล็กตรอนกัน เป็นการให้และรับอิเล้กตรอนกันโดยสมบูรณ์ ความแรงของประจุบวก ประจุลบจึงมากกว่า ดังรูป
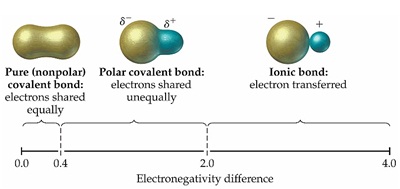
หมายเหตุ ผลต่างของค่า EN ที่ใช้จำแนกว่าเป็นไอออนิกหรือโคเวเลนต์ บางแห่งใช้
1.7 บางแห่งใช้ 2.0
(คลิ้ก
ชมพันธะมีขั้ว ไม่มีขั้ว)
ความมีขั้วหรือไม่มีขั้วของโมเลกุล
โมเลกุลโคเวเลนต์ประกอบด้วยพันธะโคเวเลนต์อย่างน้อย 1
พันธะ อาจเป็นพันธะมีขั้วหรือพันธะไม่มีขั้วหรือทั้ง 2
แบบรวมกันอยู่ในโมเลกุลเดียวกันก็ได้ โมเลกุลโคเวเลนต์อาจเป็นโมเลกุลมีขั้วหรือโมเลกุลไม่มีขั้วก็ได้ ขึ้นอยู่กับ ความสมมาตรของโมเลกุล โดยมีข้อสังเกตดังนี้
1. โมเลกุลอะตอมคู่ (diatomic molecule)
ถ้าประกอบด้วยอะตอมของธาตุเดียวกันทั้ง 2
อะตอม โมเลกุลจะไม่มีขั้ว เช่น H2 F2
Cl2 Br2 I2
ดังรูป

แต่ถ้าเกิดจากอะตอมของธาตุต่างชนิดกันจะกลายเป็นโมเลกุลมีขั้ว โดยทางด้านอะตอมที่มีค่า EN สูงกว่าจะเป็นขั้วลบ เช่น
HF ขั้วลบจะอยู่ทางด้าน F เพราะมีค่า EN สูงกว่า H ดังรูป
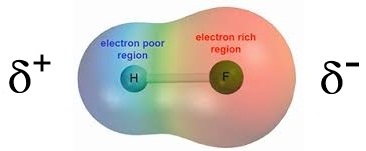
2. โมเลกุลที่มีรูปร่างสมมาตร (Symmetric) (คลิ้ก ชมลักษณะของโมเลกุลที่สมมาตร) ได้แก่ เส้นตรง สามเหลี่ยมแบนราบ ทรงเหลี่ยมสี่หน้า พีระมิดคู่ฐานสามเหลี่ยม และทรงเหลี่ยมแปดหน้า (อะตอมที่สร้างพันธะกับอะตอมกลางต้องเป็นอะตอมของธาตุเดียวกันทั้งหมดจึงจะสมมาตร) โมเลกุลจะไม่มีขั้วแม้ว่าพันธะในโมเลกุลจะเป็นพันธะมีขั้วก็ตาม
จึงจัดเป็นประเภทพันธะมีขั้วแต่โมเลกุลไม่มีขั้ว
เช่น BeF2 BF3 CH4 CCl4 PCl5 SF6 ดังรูป

แต่ถ้าอะตอมที่สร้างพันธะกับอะตอมกลางเป็นอะตอมของธาตุต่างชนิดกัน แม้ว่ารูปร่างโมเลกุลยังเหมือนเดิม แต่โมเลกุลจะไม่สมมาตร (Asymmetric) กลายเป็นโมเลกุลมีขั้ว จึงเป็นประเภทพันธะมีขั้วโมเลกุลมีขั้ว เช่น BeClF BCl2F CH3Cl CCl3F PCl2F2 SCl5F ดังรูป

ให้สังเกตว่าขั้วลบของโมเลกุลจะอยู่ทางด้านที่อะตอมซึ่งมีค่า EN สูงกว่า
เพราะเป็นด้านที่อิเล็กตรอนถูกดึงดูดไปอยู่ทางนั้นมากกว่า
เช่น
CH3Cl CH2Cl2 รูปร่างโมเลกุลเป็นทรงสี่หน้า
(tetrahedral) ขั้วลบของโมเลกุลจะอยู่ทางด้าน Cl เพราะมีค่า EN สูงกว่า H ดังรูป

3. โมเลกุลที่ไม่สมสาตร (Asymetric) ได้แก่โมเลกุลที่มีรูปร่างเป็นมุมงอ
(bent) เช่น H2O พีระมิดฐาน
สามเหลี่ยม (trigonal pyramid) เช่น NH3 ม้ากระดก (see saw) เช่น SCl4 ตัวที (T- shape) เช่น ClF3
เป็นโมเลกุลมีขั้ว โดยขั้วลบจะอยู่ทางด้านอะตอมที่มีค่า EN มากกว่า ดังรูป

(คลิ้ก ชมสมบัติของโมเลกุลมีขั้ว-ไม่มีขั้วเมื่ออยู่ในสนามไฟฟ้า
และอธิบายการเกิดโมเลกุลมีขั้ว-ไม่มีขั้ว)
ความมีขั้วของโมเลกุลกับการละลายของสาร
การละลายของสารโคเวเลนต์ต่างจากการละลายของสารไอออนิก
คือการละลายของสารโคเวเลนต์จะไม่แตกตัวเป็นไอออน
(ยกเว้นสารโคเวเลนต์จำพวกกรดต่าง ๆ )
สารละลายจึงไม่นำไฟฟ้า (non-electrolyte) ในขณะที่การละลายของสารไอออนิกจะแตกตัวเป็นไอออน ทำให้สารละลายนำไฟฟ้าได้ (electrolyte)
ขั้วของโมเลกุลและขั้วของตัวทำละลายมีผลต่อการละลายของสารต่าง
ๆ คือสารโมเลกุลมีขั้วจะละลายได้ในตัวทำละลายที่โมเลกุลมีขั้ว
(polar solvent) สารโมเลกุลไม่มีขั้วจะละลายได้ในตัวทำละลายที่โมเลกุลไม่มีขั้ว
(non polar solvent) แต่สำหรับสารไอออนิกแล้ว จะละลายในทำละลายโมเลกุลมีขั้วเท่านั้น
(คลิ้ก ชมการละลายของ C6H12O6)
(คลิ้ก ชมการละลายของ NaCl) (คลิ้ก ชมการละลายของกรด)
**
สารโมเลกุลมีขั้วกับสารโมเลกุลไม่มีขั้วจะไม่ละลายซึ่งกันและกัน เมื่อผสมกันจะแยกชั้นกัน ไม่รวมตัวเป็นเนื้อเดียว เช่น น้ำกับสารไฮโดรคาร์บอน หรือมักจะกล่าวว่าน้ำกับน้ำมัน น้ำเป็นสารโมเลกุลมีขั้ว สารไฮโดรคาร์บอนได้แก่น้ำมันต่าง ๆ เป็นสารโมเลกุลไม่มีขั้ว เมื่อผสมกันจะแยกชั้นกัน สารที่มีความหนาแน่นน้อยกว่าจะอยู่ชั้นบน
(คลิ้ก ชมการผสมระหว่างสารไม่มีขั้วกับตัวทำละลายมีขั้ว)
** สมบัติของสารที่เกิดจากขั้วของโมเลกุลที่มีผลต่อการละลายของสารในตัวทำละลายประเภทต่าง
ๆ ดังกล่าวมานี้
ใช้ประโยชน์ในการสกัดสารโดยใช้ตัวทำละลาย
ถ้าเราทราบชนิดของสารที่ต้องการสกัด
เราจะเลือกตัวทำละลายให้เหมาะสมกับสารที่เราต้องการสกัดได้ เช่น
ต้องการสกัดน้ำมันจากรำข้าว เราทราบว่าน้ำมันเป็นสารโมเลกุลไม่มีขั้ว ฉะนั้นเราต้องเลือกใช้ตัวทำละลายชนิดโมเลกุลไม่มีขั้ว เช่น
เฮกเซน (C6H14) ถ้าใช้น้ำจะสกัดไม่ได้เพราะน้ำเป็นตัวทำละลายมีขั้ว แต่ถ้าต้องการสกัดสารที่โมเลกุลมีขั้ว เราต้องใช้ตัวทำละลายชนิดโมเลกุลมีขั้ว เช่น
ต้องการสกัดวิตามีนซีจากผลไม้
วิตามินซีเป็นสารโมเลกุลมีขั้ว
ควรใช้น้ำเป็นตัวทำละลาย ถ้าใช้เฮกเซนจะสกัดไม่ได้เพราะเฮกเซนเป็นตัวทำละลายไม่มีขั้ว เป็นต้น
มีการจำแนกวิตามินออกเป็น 2
ประเภท คือ วิตามิน
เอ ดี อี
เค
เป็นวิตามินที่ละลายในน้ำมัน
ในขณะที่วิตามิน บี ซี
เป็นวิตามินที่ละลายในน้ำ
น้ำมันเป็นสารโมเลกุลไม่มีขั้ว
แสดงว่าวิตามิน เอ ดี อี เค
เป็นสารโมเลกุลไม่มีขั้ว
แต่วิตามิน บี ซี
เป็นสารโมเลกุลมีขั้ว จึงละลายในน้ำซึ่งเป็นสารโมเลกุลมีขั้ว
การทำโครงงานวิทยาศาสตร์หรือการวิจัยเกี่ยวกับการสกัดสารเพื่อนำมาทดสอบสมบัติในด้านต่าง
ๆ ถ้าไม่ทราบว่าสิ่งที่นำมาสกัดมีสารอะไรอยู่บ้าง ควรใช้ตัวทำละลายทั้ง 2
แบบ เพื่อให้สกัดสารได้สารทั้ง 2
ประเภท คือทั้งชนิดโมเลกุลมีขั้วและชนิดโมเลกุลไม่มีขั้ว
เช่น
ทดลองสกัดสารจากสมุนไพรชนิดหนึ่งเพื่อนำไปทดสอบสมบัติด้านใดด้านหนึ่งตามที่สนใจ ควรแบ่งกลุ่มทดลองเป็น 2
กลุ่ม
คือกลุ่มที่ทดสอบสมบัติของสารที่สกัดได้จากตัวทำละลายมีขั้ว เช่น
สกัดโดยเอทานอล และกลุ่มที่ทดสอบสมบัติของสารที่สกัดได้จากตัวทำละลายไม่มีขั้ว เช่น
สกัดโดยเฮกเซน
สารซักล้างต่าง ๆ (detergent) เช่น ผงซักฟอก
น้ำยาล้างจาน สบู่ แชมพู....
เป็นสารที่มีโมเลกุลใหญ่ มีทั้งส่วน
มีขั้วและไม่มีขั้วอยู่ในโมเลกุลเดียวกัน ด้านหนึ่งของโมเลกุลจะมีขั้ว ขณะที่อีกด้านหนึ่งไม่มีขั้ว ดังรูป
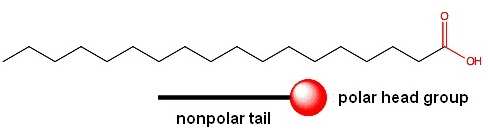
โครงสร้างโมเลกุลของสารซักล้าง ส่วนหางไม่มีขั้ว ขณะที่ส่วนหัวมีขั้ว ส่วนหางประกอบด้วย C และ H จำนวนมาก
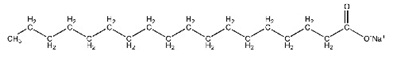
โดยอาจมีลักษณะเป็นโซ่ตรงหรือแยกเป็นสาขาก็ได้ และอาจมี C6H6 (Benzene) อยู่ด้วยก็ได้ ดังรุป
การที่โมเลกุลของสารซักล้างมีทั้งส่วนมีขั้วและไม่มีขั้วอยู่ในโมเลกุลเดียวกัน ทำให้ล้างคราบไขมันหรือน้ำมันได้ดี เพราะขณะซักล้างส่วนของโมเลกุลที่ไม่มีขั้วคือส่วนหางจะรวมตัวกับไขมันหรือน้ำมัน ในขณะที่ส่วนมีขั้วของโมเลกุลคือส่วนหัวจะหันออกด้านน้อ เมื่อล้างน้ำส่วนหัวจะรวมตัวกับน้ำขณะที่ส่วนหางติดอยู่กับน้ำมัน น้ำกับน้ำมันจึงไปด้วยกันทำให้ผสมกันได้กลายเป็นคอลลอยด์อีมัลชัน
(emulsion) โดยสารซักล้างเป็นอีมัลซิฟายเออร์
(emulsifier) ดังรูป

แรงยึดเหนี่ยวระหว่างโมเลกุล (Intermolecular force , IMF)
เมื่อโมเลกุลโคเวเลนต์อยู่รวมกัน
ไม่ว่าจะเป็นโมเลกุลของสารเดียวกันหรือโมเลกุลของสารต่างชนิดกัน
โมเลกุลเหล่านั้นก็จะมีแรงยึดเหนี่ยวซึ่งกันและกันทำให้อยู่รวมกันได้ แรงยึดเหนี่ยวระหว่างโมเลกุลเกิดขึ้นได้หลายแบบ แต่ละแบบมีค่าไม่เท่ากัน แรงดังกล่าวมีผลต่อสมบัติทางกายภาพของสาร ที่เห็นได้ชัดก็คือมีผลต่อการเปลี่ยนสถานะของสาร
สังเกตได้จากสารแต่ละชนิดมีจุดหลอมเหลว(จุดเยือกแข็ง)และจุดเดือดแตกต่างกัน สารที่มีแรงยึดเหนี่ยวระหว่างโมเลกุลมากจะมีจุดหลอมเหลวและจุดเดือดสูง ตรงข้ามกับสารที่มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย จะมีจุดหลอมเหลวและจุดเดือดต่ำกว่า เช่น
น้ำ มีจุดหลอมเหลว 0 oC มีจุดเดือด 100 oC ในขณะที่เอทานอล มีจุดหลอมเหลว -114 oC มีจุดเดือด 78.37 oC แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลของน้ำมีมากกว่าแรงยึดเหนี่ยวระหว่างโมเลกุลของเอทานอล ตำแหน่งของแรงยึดเหนี่ยวเป็นดังรูป

(คลิ้ก
ชมการเปลี่ยนสถานะของสารกับพลังงาน)
(คลิ้ก ชมการเปลี่ยนสถานะของสาร)
สารแต่ละชนิดทั้งของแข็งและของเหลวรวมกันอยู่ได้ดัวยแรงยึดเหนี่ยวระหว่างอนุภาค การหลอมเหลวและการเดือดหรือการกลายเป็นไอของสารใด
ๆ
เกิดขึ้นเพราะมีความร้อนไปทำลายแรงยึดเหนี่ยวระหว่างอนุภาคของสาร ถ้าสารมีแรงยึดเหนี่ยวระหว่างอนุภาคอยู่มาก ก็จะต้องใช้ความร้อนมาก จึงมีจุดหลอมเหลวและจุดเดือดสูง พิจารณาจุดเดือดของสารบางชนิด ดังกราฟต่อไปนี้
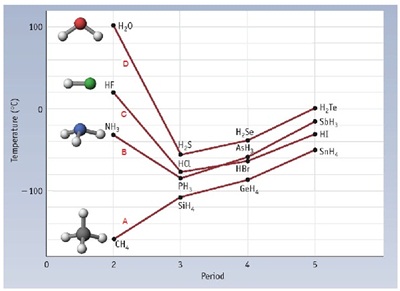
ให้สังเกตว่าในกราฟแบ่งสารออกเป็น 4
ชุด คือ A
B C และ D
- ชุด A เป็นสารประกอบของธาตุหมู่ 4A กับ H เป็นสารโมเลกุลไม่มีขั้ว
- ชุด B เป็นสารประกอบของธาตุหมู่ 5A กับ H เป็นสารโมเลกุลมีขั้ว
- ชุด C เป็นสารประกอบของธาตุหมู่ 7A กับ H เป็นสารโมเลกุลมีขั้ว
- ชุด D เป็นสารประกอบของธาตุหมู่ 6A กับ H เป็นสารโมเลกุลมีขั้ว
จุดเดือดของสารชุด A จะต่ำกว่าสารชุดอื่น
ๆ แต่มีแนวโน้มว่าเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น
จุดเดือดของสารชุด B
C และ D ซึ่งเป็นสารโมเลกุลมีขั้วมีจุดเดือดสูงกว่าสารชุด A ทุกชนิด
แสดงว่าวสารโมเลกุลมีขั้ว (ชุดนี้)
มีแรงยึดเหนียวระหว่างโมเลกุลมากกว่าสารโมเลกุลไม่มีขั้ว และมีแนวโน้มว่าจุดเดือดจะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้นเช่นกัน
แต่ให้สังเกตว่า NH3 HF และ H2O เป็นสารชนิดแรกของชุด A B และ C ซึ่งมีมวลโมเลกุลน้อยที่สุดในแต่ละชุด แต่มีจุดเดือดสูงที่สุดของสารทั้งชุด แสดงว่ามีแรงยึดเหนี่ยวระหว่างโมเลกุลมากเป็นพิเศษ
แรงยึดเหนี่ยวระหว่างโมเลกุลจำแนกเป็น 2
ประเภท คือ
1. แรงอย่างอ่อน
เรียกว่าแรงวันเดอร์วาล (van der vaal force or van der vaals interaction) มี 3 ชนิด
ย่อย ๆ คือ
1.1 แรงลอนดอน (London Dispersion Force) ผู้ค้นพบแรงชนิดนี้คือ Fritz Wolfgang London (March 7,
1900–March 30, 1954
, พ.ศ.
2443-2497) เป็นแรงที่เกิดขึ้นระหว่างโมเลกุลไม่มีขั้ว
หรือเกิดขึ้นกับอะตอมเดี่ยว ๆ ก็ได้ เกิดจากการที่อิเล็กตรอนของแต่ละโมเลกุล หรือของอะตอมเดี่ยวมีการถ่ายเทไปทางด้านใดด้านหนึ่งของโมเลกุลหรือของอะตอมมากกว่าอีกด้านหนึ่งมากกว่าอีกด้านหนึ่ง แต่ไม่ถาวรมีการเปลี่ยนที่ไปยังด้านใดด้านหนึ่งของโมเลกุลหรืออะตอมอยู่ตลอดเวลา ทำให้โมเลกุลหรืออะตอมทางด้านที่อิเล็กตรอนถ่ายเทไปมากเกิดขั้วไฟฟ้าลบขึ้นมาเล็กน้อยเพียงชั่วคราว แต่ก็เกิดขึ้นอยู่ตลอดเวลาในแต่ละด้านของโมเลกุลหรืออะตอม ทำให้เกิดแรงยึดเหนี่ยวระหว่างโมเลกุลหรืออะตอมขึ้นมาได้
แรงชนิดนี้มีค่าน้อยแต่จะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น หรือเมื่อโมเลกุลมีขนาดใหญ่ขึ้น เป็นเพราะมีพื้นที่ผิวของโมเลกุลมากขึ้นและจำนวนอิเล็กตรอนมีมากขึ้นด้วย ทำให้โอกาสที่อิเล็กตรอนจะถ่ายเทไปทางด้านหนึ่งมากกว่าอีกด้านหนึ่งมีมากขึ้น ฉะนั้นในบรรดาสารที่โมเลกุลไม่มีขั้วชนิดต่าง ๆ สารที่มีมวลโมเลกุลมากก็จะมีแรงลอนดอนมากด้วย จึงมีจุดหลอมเหลวและจุดเดือดสูงกว่าชนิดที่มีมวลโมเลกุลน้อย
พิจารณาจากกราฟ สาร CH4 (มวลโมเลกุล
16) SiH4 (มวลโมเลกุล 32) GeH4
(มวลโมเลกุล 77) SnH4(มวลโมเลกุล 123)
จะเห็นได้ว่ามีจุดเดือดเพิ่มขึ้นตามลำดับ
ถ้าย้อนกลับไปพิจารณาเรื่องสมบัติของธาตุจากตารางธาตุกันอีกครั้งหนึ่ง ดูที่ธาตุหมู่
7A
และ 8A พบว่าจุดธาตุคาบล่างมีหลอมเหลวและจุดเดือดสูงกว่าธาตุคาบบน ที่เป็นดังนี้เป็นเพราะธาตุคาบล่างมีมวลอะตอมหรือมวลโมเลกุลมากกว่า จึงเกิดแรงลอนดอนได้มากกว่า
ทำให้มีแรงดึงดูดระหว่างอะตอมหรือโมเลกุลมากกว่า จุดหลอมเหลวและจุดเดือดจึงสูงกว่า
แรงลอนดอนเป็นแรงยึดเหนี่ยวระหว่างโมเลกุลที่เป็นแรงขั้นพื้นฐานของทุกโมเลกุล
แต่ถ้ามีแรงชนิดอื่นที่มีค่ามากกว่าก็จะไม่กล่าวถึงแรงลอนดอน
(คลิ้ก ชมการเกิดแรงลอนดอน) (คลิ้ก ชมการเกิดแรงลอนดอน)
1.2 แรงระหว่างขั้วอย่างถาวร (permanent
dipole-dipole attractions , interaction) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลมีขั้วกับโมเลกุลมีขั้ว
โดยอาจเป็นโมเลกุลของสารเดียวกันหรือจะเป็นโมเลกุลของสารต่างชนิดกันก็ได้ แรงชนิดนี้มีค่ามากกว่าแรงลอนดอน
(เมื่อเปรียบเทียบกันที่มวลโมเลกุลเท่า ๆ กัน)
จึงมีผลให้สารโมเลกุลมีขั้วมีจุดหลอมเหลวและจุดเดือดสูงกว่าสารโมเลกุลไม่มีขั้ว เมื่อมีมวลโมเลกุลเท่ากันหรือใกล้เคียงกัน

(คลิ้ก ชมลักษณะของแรงระหว่างขั้ว)
1.3 แรงระหว่างขั้วเหนี่ยวนำ (induce
dipole force , temporary dipole) เป็นแรงที่เกิดขึ้นระหว่าง ไอออน
หรือโมเลกุลมีขั้ว กับอะตอมหรือโมเลกุลไม่มีขั้ว อธิบายได้ว่าอะตอมอิสระของธาตุต่าง ๆ จะมีรูปร่างเป็นทรงกลมเมื่ออยู่ในภาวะปกติจะไม่มีขั้ว
แต่เมื่ออยู่ใกล้กับไอออนหรือโมเลกุลมีขั้ว
ก็จะถูกไอออนหรือโมเลกุลมีขั้วเหนี่ยวนำให้มีขั้วขึ้นมาได้เล็กน้อย แล้วเกิดแรงยึดเหนี่ยวซึ่งกันและกัน

2.
พันธะไฮโดรเจน (Hydrogen Bonds , H-Bond) โดยรูปแบบแล้วมีลักษณะเดียวกับแรงระหว่างขั้ว (ข้อ 1.2) แต่มีความแข็งแรงมากกว่าแรงระหว่างขั้วแบบบธรรมดา เนื่องจากเป็นขั้วที่เกิดจากอะตอมมีความแตกต่างของค่า EN กันมาก ได้แก่ขั้วที่เกิดจากพันธะระหว่าง H-N
H-O และ H-F ดังแสดงในตารางต่อไปนี้
|
ธาตุ
|
ค่า EN
|
พันธะระหว่าง
|
ผลต่างของค่า EN
|
|
H
|
2.20
|
-
|
-
|
|
N
|
3.04
|
H-N
|
3.04 –
2.20 = 0.84
|
|
O
|
3.44
|
H-O
|
3.44 – 2.20 = 1.24
|
|
F
|
3.98
|
H-F
|
3.98 –
2.20 = 1.78
|
เมื่อพิจารณาจากผลต่างของค่า EN ระหว่าง
H-N H-O และ H-F จะเห็นได้ว่าต่างกันมากแต่ไม่เท่ากัน ยิ่งต่างกันมากความแรงของขั้วก็จะยิ่งมากขึ้น ฉะนั้นความแรงของพันธะไฮโดรเจนจะมีลำดับดังนี้ H-F > H-O >
H-N แต่เมื่อเปรียบเทียบจุดเดือดระหว่าง HF
H2O และ NH3 (กราฟหน้า 160 ) กลับพบว่าจุดเดือดของ H2O > HF >NH3 อธิบายได้ว่า
-
แรงยึดเหนี่ยวระหว่างโมเลกุลของทุกชนิด
จะประกอบด้วยแรงอย่างน้อย 2 ชนิดร่วมกัน
ได้แก่แรงลอนดอนร่วมกับแรงชนิดอื่น
แรงลอนดอนจะเกิดขึ้นกับทุกโมเลกุลไม่ว่าจะเป็นโมเลกุลมีขั้วหรือไม่มีขั้ว แรงชนิดนี้จะมากขึ้นตามมวลโมเลกุลของสาร HF H2O และ NH3 มีมวลโมเลกุล
20 18 และ
17 ตามลำดับ ฉะนั้นแรงลอนดอนของ HF
> H2O >
NH3
-
คราวนี้มาดูจำนวนพันธะไฮโดรเจนกันบ้าง H – F มีพันธะไฮโดรเจน 1
ตำแหน่ง (EN = 1.78)
H2O มีพันธะไฮโดรเจน 2 ตำแหน่ง (EN = 1.24 x 2 = 2.48)
NH3
มีพันธะไฮโดรเจน 3 ตำแหน่ง (EN = 0.84 x 3 = 2.52)
-
นำทั้ง 2 กรณีมาพิจารณาร่วมกัน ทำให้แรงยึดเหนี่ยวระหว่างโมเลกุลของ H2O จะมากกว่า HF จึงมีผลให้ H2O มีจุดเดือดสูงกว่า HF
สำหรับ H2O กับ NH3 พบว่า EN ของ
NH3
สูงกว่า EN
ของ H2O แต่มวลโมเลกุลของ H2O สูงกว่า NH3 อยู่เพียง 1
หน่วย ซึ่งถือว่าน้อย ต้องพิจารณารูปร่างโมเลกุลมาเปรียบเทียบกัน
มีหลักการว่ารูปร่างโมเลกุลที่มีพื้นที่ผิวมากจะเกิดแรงลอนดอนระหว่างโมเลกุลได้มากกว่ารูปร่างโมเลกุลที่มีพื้นที่ผิวน้อย เช่น
บิวเทน (C4H10) มีโครงสร้างโมเลกุล 2 แบบ มีจุดเดือดต่างกัน ดังรูป

ด้านซ้ายเป็นโมเลกุลที่มีโครงสร้างแบบโซ่ตรง
(Straigth Chain) มีพื้นที่ผิวของโมเลกุลมากกว่าโครงสร้างโมเลกุลค้านขวาที่เป็นแบบโซ่กิ่ง
(Branch chain)
ถ้าใช้หลักการนี้กับ H2O
กับ NH3
บ้างก็ต้องเปรียบเทียบกันที่รูปร่างโมเลกุล H2O เป็นแบบมุมงอ
NH3
เป็นแบบพีระมิดฐานสามเหลี่ยม
โมเลกุลของ H2O
จะมีพื้นที่ผิวที่จะเกิดแรงยึดเหนี่ยวกับ
H2O
โมเลกุลอื่นมากกว่า NH3 ฉะนั้นถึงแม้จะมีผลต่างของค่า EN ต่ำกว่าแต่ก็มีจุดเดือดสูงกว่า
พันธะไฮโดรเจนเกิดขึ้นได้
2 แบบคือ
1 เป็นแรงดึงดูดระหว่างโมเลกุลที่ต่างก็มีพันธะ H-N
H-O และ H-F ชนิดใดชนิดหนึ่งอยู่ในโมเลกุลทั้งคู่ เช่น

(คลิ้ก ชมลักษณะของไฮโดรเจนบอนด์)
2 เป็นแรงดึงดูดระหว่างโมเลกุลที่โมเลกุลหนึ่งมีพันธะ
H-N H-O หรือ H-F อย่างใดอย่างหนึ่ง
กับ O หรือ N ของอีกโมเลกุลหนึ่ง ที่อยู่ในรูป
– C =O
หรือ –C=N ดังรูป

(คลิ้ก อ่านข้อมูลเพิ่มเติมเกี่ยวกับแรงยึดเหนี่ยวระหว่างโมเลกุล)
สมบัติทางกายภาพที่มีผลมาจากพันธะไฮโดรเจนที่เห็นได้ชัดคือ
สารที่มีพันธะไฮโดรเจนระหว่างโมเลกุลจะมีจุดเดือดสูงกว่าสารอื่น ๆ
ที่มีมวลโมเลกุลใกล้เคียงกัน
แต่ไม่มีแรงดึงดูดชนิดนี้ระหว่างโมเลกุล
|
เปรียบเทียบจุดเดือดของสาร
|
|
สารประกอบ
|
CH4
|
NH3
|
H2O
|
HF
|
SiH4
|
PH3
|
H2S
|
HCl
|
|
แรงยึดเหนี่ยวระหว่างโมเลกุล
|
London
|
H-bond
|
H-bond
|
H-bond
|
London
|
dipole
|
dipole
|
dipole
|
|
มวลโมเลกุล
|
16
|
17
|
18
|
20
|
32
|
34
|
34
|
36
|
|
จุดเดือด (0C)
|
-161
|
-33
|
+100
|
+20
|
-111
|
-88
|
-60
|
-85
|
ถ้าเปรียบเทียบความแข็งแรงกันระหว่างแรงยึดเหนี่ยวชนิดต่าง
ๆ จะเป็นดังนี้
|
เปรียบเทียบความแข็งแรงของพันธะ
(Relative Bond Strengths)
|
|
Ionic(or Covalent) bonds
|
1000
|
|
Hydrogen bonds
|
100
|
|
Dipole - Dipole
|
10
|
|
Dipole - Induced Dipole
|
5
|
|
London Forces
|
1
|
(แบบฝึกหัดอยู่่ตอนถัดไป , 9/1)
รูปภาพที่เกี่ยวข้อง

Size : 18.69 KBs
Upload : 2013-01-28 05:34:08
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|