พันธะเคมี ตอนที่ 1 พันธะไอออนิก การเขียนสูตรและการเรียกชื่อ
พันธะเคมี (Chemical Bonding)
ในบรรดาธาตุทั้งหมดที่มีอยู่ในโลกดังที่ปรากฏอยู่ในตารางธาตุนั้น เราพบว่ามีอยู่เพียง 6
ธาตุ คือธาตุหมู่ที่ 8A ได้แก่ He Ne
Ar Kr Xe และ Rn เท่านั้นที่สามารถดำรงอยู่ได้ด้วยอะตอมของมันเพียงอะตอมเดียว โดยไม่จำเป็นต้องรวมตัวกับอะตอมอื่น
ไม่ว่าจะเป็นอะตอมของธาตุเดียวกันหรืออะตอมของธาตุต่างชนิด ธาตุเหล่านี้มีสถานะเป็นแก๊สที่อุณหภูมิห้อง เดิมเคยเรียกว่าแก๊สเฉื่อย (Inert gas) ปัจจุบันเรียกว่าแก๊สมีตระกูล
(Noble gas) เราเขียนสูตรของแก๊สเหล่านี้ด้วยสัญลักษณ์ของธาตุนั้น ๆ
โดยไม่ต้องเติมตัวเลขใด ๆ ลงไป
ต่างจากแก๊สอื่น ๆ
ที่เราจะเขียนแทนด้วยสัญลักษณ์หรือสูตรที่มีตัวเลขกำกับ เช่น H2
N2 Cl2 F2 O2 O3 … ความแตกต่างนี้เกิดจากโครงสร้างอะตอมของธาตุหมู่ 8A แต่ละธาตุมีลักษณะพิเศษกว่าอะตอมของธาตุอื่น ๆ
ทำให้สามารถอยู่ได้ด้วยอะตอมเพียงอะตอมเดียว (แต่ปัจจุบันสามารถทำให้บางธาตุทำปฏิกิริยาเกิดสารประกอบได้) โครงสร้างอะตอมของธาตุเหล่านี้เป็นโครงสร้างที่มีความเสถียร (Stable) มาก คำว่าเสถียรหมายถึงภาวะของระบบที่มีพลังงานต่ำ ทำให้ดำรงอยู่ได้ในสภาพนั้น
ระบบยิ่งมีพลังงานต่ำเท่าไรความเสถียรก็จะยิ่งเพิ่มขึ้น ความเสถียรของธาตุหมู่ 8A เกิดจากการจัดอิเล็กตรอนแบบจัดเต็มทุกออร์บิทัลและมีเวเลนซ์อิเล็กตรอน
= 8 ยกเว้น He มีเวเลนซ์อิเล็กตรอน = 2 ดังแสดงในตารางต่อไปนี้

(คลิ้กเพื่อเปิดตารางธาตุ)
(คลิ้กเพื่อเปิดตารางธาตุแสดงการจัดอิเล็กตรอน)
จะเห็นได้ว่าถ้ายกเว้นแก๊ส He แล้วธาตุหมู่ 8A ทุกธาตุล้วนมีเวเลนซ์อิเล็กตรอนเท่ากับ
8
ทั้งสิ้น
การมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 เรียกว่ากฎออกเตต (Octet rule) เป็นการจัดอิเล็กตรอนเต็มทุกออร์บิทัลทำให้อะตอมมีพลังงานต่ำจึงเสถียร
แต่สำหรับอะตอมของธาตุอื่น ๆ ล้วนมีเวเลนซ์อิเล็กตรอนเป็นจำนวนอื่น ๆ ที่ไม่เท่ากับ
8
จึงมีอิเล็กตรอนเดี่ยวอยู่ในบางออร์บิทัล เวเลนซ์อิเล็กตรอนไม่เท่ากับ 8 ไม่เป็นไปตามกฎออกเต็ต ทำให้อะตอมมีพลังงานสูงจึงไม่เสถียร (unstable) อะตอมจะปรับรูปแบบในการจัดอิเล็กตรอนเสียใหม่ให้เป็นไปตามกฎออกเต็ต โดยร่วมกับอะตอมอื่นที่มีเวเลนซ์อิเล็กตรอนไม่แป็นไปตามกฏออกเต็ตเช่นกัน กระบวนการนี้มีความแตกต่างระหว่างอะตอมของโลหะกับอะตอมของอโลหะ ได้แก่
1. อะตอมของโลหะ
ส่วนใหญ่จะมีเวเลนซ์อิเล็กตรอน
1 หรือ 2
(มีโลหะไม่กี่ชนิดที่มีเวเลนซ์อิเล็กตรอนมากกว่า 2
ได้แก่อลูมิเนียม , Al
มีเวเลนซ์อิเล็กตรอน = 3
ดีบุก ,Sn และตะกั่ว, Pb มีเวเลนซ์อิเล็กตรอน = 4 บิสมัส , Bi มีเวเลนซ์อิเล็กตรอน = 5 ) ถ้าเป็นโลหะหมู่ A จะพบว่าจำนวนอิเล็กตรอนชั้นที่ถัดจากเวเลน์อิเล็กตรอนเข้าไปจะมี =
8
โลหะจึงใช้วิธีเสียเวเลนซ์อิเล็กตรอนให้แก่อะตอมอื่น เมื่ออะตอมเสียเวเลนซ์อิเล็กตรอนไปแล้ว อิเล็กตรอนชั้นที่อยู่ถัดเข้าไปซึ่งมี = 8
ก็จะกลายเป็นเวเลนซ์อิเล็กตรอนเสียเองและเป็นไปตามกฎออกเต็ต แต่อนุภาคจะอยู่ในรูปของไอออนบวก (cation)
2. อะตอมของอโลหะ ส่วนมากจะมีเวเลนซ์อิเล็กตรอนตั้งแต่ 4
ขึ้นไป (ยกเว้น H
มีเวเลนซ์อิเล็กตรอน = 1)
และอโลหะส่วนใหญ่จะมีค่า EN สูง
จึงเสียอิเล็กตรอนยากแต่สามารถรับอิเล็กตรอนจากอะตอมอื่นได้ง่ายกว่า อะตอมของอโลหะจะรับอิเล็กตรอนจากอะตอมของอโลหะ ตามจำนวนที่จะทำให้มีเวเลนซ์อิเล็กตรอน
= 8 แต่อะตอมก็จะกลายเป็นไอออนลบ
(anion) ดังรูป

3. อะตอมของอโลหะเมื่ออยู่ร่วมกัน จะใช้วิธีใช้อิเล็กตรอนร่วมกันเป็นคู่ ๆ เพื่อให้ทั้ง
2 ฝ่าย มีเวเลนซ์อิเล็กตรอน
= 8
(คลิ้ก ชมวิธีจัดอิเล็กตรอนเป็นไปตามกฎออกเตตของธาตุโลหะและอโลหะบางชนิด)
การที่อะตอมตั้งแต่ 2
อะตอมขึ้นไปมาอยู่ร่วมกัน
และมีส่วนร่วมในการจัดอิเล็กตรอนซึ่งกันและกัน ทำให้แต่ละอะตอมมีเวเลน์ซ์อิเล็กตรอน = 8 จะเรียกสิ่งที่เกิดขึ้นนี้ว่าเป็นการสร้างพันธะเคมี (Chemical
bonding) หรือจะเรียกว่าการทำปฏิกิริยาเคมีกันก็ได้
ทำให้อะตอมหรืออนุภาคมีแรงยึดเหนี่ยวซึ่งกันและกัน เรียกแรงยึดเหยี่ยวที่เกิดขึ้นว่าพันธะเคมี (chemical bond) มีได้ 3
แบบ คือ พันธะไอออนิก
พันธะโคเวเลนต์และพันธะโลหะ
พันธะไอออนิก (Ionic bond)
เป็นการสร้างพันธะระหว่างอะตอมของโลหะกับอโลหะ ถ้าเราพิจารณาการจัดอิเล็กตรอนของโลหะหมู่ 1A และ 2A เปรียบเทียบกับการจัดอิเล็กตรอนของแก๊สเฉื่อยจะเป็นดังนี้
|
คาบที่
|
1A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
-
|
2He
|
2
|
|
2
|
3Li
|
2 1
|
10Ne
|
2 8
|
|
3
|
11Na
|
2 8
1
|
18Ar
|
2 8
8
|
|
4
|
19K
|
2 8
8 1
|
36Kr
|
2 8
18 8
|
|
5
|
37Rb
|
2 8
18 8 1
|
54Xe
|
2 8
18 18 8
|
|
6
|
55Cs
|
2 8
18 18 8
1
|
86Rn
|
2 8
18 32 18
8
|
|
คาบที่
|
2A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
-
|
2He
|
2
|
|
2
|
4Be
|
2 2
|
10Ne
|
2 8
|
|
3
|
12Mg
|
2 8
2
|
18Ar
|
2 8
8
|
|
4
|
20Ca
|
2 8
8 2
|
36Kr
|
2 8
18 8
|
|
5
|
38Sr
|
2 8
18 8 2
|
54Xe
|
2 8
18 18 8
|
|
6
|
50Ba
|
2 8
18 18 8
2
|
86Rn
|
2 8
18 32 18
8
|
จะเห็นได้ว่าธาตุหมู่ 1A และ 2A ทุกธาตุต่างก็มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 และ 2 ตามลำดับ8 8 18 1 แต่จำนวนอิเล็กตรอนชั้นที่ถัดจากเวเลนซ์อิเล็กตรอนเข้ามาจะมีเท่ากับ
8 ฉะนั้นถ้าเสียเวเลนซ์อิเล็กตรอนไป จะมีผลให้มีเวเลนซ์อิเล็กตรอน =
8 เหมือนแก๊สเฉื่อยที่อยู่เหนือขึ้นไป 1 คาบ แต่อะตอมก็จะกลายเป็นไอออนบวก ซึ่งมีจำนวนประจุบวกจะเท่ากับจำนวนอิเล็กตรอนที่เสียไป ดังตารางต่อไปนี้
|
คาบที่
|
1A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
|
2He
|
2
|
|
2
|
3Li+
|
2
|
10Ne
|
2 8
|
|
3
|
11Na+
|
2 8
|
18Ar
|
2 8
8
|
|
4
|
19K+
|
2 8
8
|
36Kr
|
2 8 18
8
|
|
5
|
37Rb+
|
2 8
18 8
|
54Xe
|
2 8
18 18 8
|
|
6
|
55Cs+
|
2 8
18 18 8
|
86Rn
|
2 8 18
32 18 8
|
|
7
|
88Ra+
|
2 8
18 32 18
8
|
|
|
สำหรับธาตุหมู่ 2A
เมื่อเสียเวเลนซ์อิเล็กตรอนไป 2
ตัว จะเป็นดังนี้
|
คาบที่
|
2A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
|
2He
|
2
|
|
2
|
4Be2+
|
2 (เกิดขึ้นยาก)
|
10Ne
|
2 8
|
|
3
|
12Mg2+
|
2 8
|
18Ar
|
2 8
8
|
|
4
|
20Ca2+
|
2 8
8
|
36Kr
|
2 8 18
8
|
|
5
|
38Sr2+
|
2 8
18 8
|
54Xe
|
2 8
18 18 8
|
|
6
|
50Ba2+
|
2 8
18 18 8
|
86Rn
|
2 8 18
32 18 8
|
|
7
|
88Ra2+
|
2 8
18 32 18
8
|
|
|
ถ้าพิจารณาการจัดอิเล็กตรอนของอโลหะหมู่ 7A เปรียบเทียบกับแก๊สเฉื่อยจะพบว่า ธาตุหมู่
7A
มีเวเลนซ์อิเล็กตรอนน้อยกว่าแก๊สเฉื่อยที่อยู่คาบเดียวกันอยู่ 1
ตัว ดังตาราง
|
คาบที่
|
7A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
|
2He
|
2
|
|
2
|
9F
|
2 7
|
10Ne
|
2 8
|
|
3
|
17Cl
|
2 8 7
|
18Ar
|
2 8 8
|
|
4
|
35Br
|
2 8
18 7
|
36Kr
|
2 8
18 8
|
|
5
|
53I
|
2 8
18 8 7
|
54Xe
|
2 8
18 18 8
|
ถ้าธาตุหมู่
7A ได้รับอิเล็กตรอน 1 ตัว จะกลายเป็นไอออนลบ
แต่จะมีการจัดอิเล็กตรอนเหมือนแก๊สเฉื่อยที่อยู่คาบเดียวกัน ดังตาราง
|
คาบที่
|
7A
|
การจัดอิเล็กตรอน
|
แก๊สเฉื่อย
|
การจัดอิเล็กตรอน
|
|
1
|
-
|
|
2He
|
2
|
|
2
|
9F-
|
2 8
|
10Ne
|
2 8
|
|
3
|
17Cl-
|
2 8 8
|
18Ar
|
2 8 8
|
|
4
|
35Br-
|
2 8
18 8
|
36Kr
|
2 8
18 8
|
|
5
|
53I-
|
2 8
18 8 8
|
54Xe
|
2 8
18 18 8
|
เมื่ออะตอมของโลหะกับอโลหะอยู่ร่วมกัน
จะมีการถ่ายเทอิเล็กตรอนจากอะตอมของโลหะมายังอะตอมของอโลหะ เพราะโลหะมีค่า EN และ IE ต่ำ ในขณะที่อโลหะมีค่า EN และ EA สูง จึงทำให้อะตอมของโลหะเปลี่ยนเป็นไอออนบวก ขณะที่อะตอมของอโลหะเปลี่ยนเป็นไอออนลบ จึงดึงดูดซึ่งกันทำให้รวมตัวกันกลายเป็นสารประกอบไอออนิก
(ionic compounds) เรียกแรงดึงดูดนี้ว่าพันธะไอออนิก (Ionic bond) พิจารณาการถ่ายเทอิเล็กตรอนระหว่างอะตอมของโซเดียมกับอะตอมของคลอรีน ดังรูปต่อไปนี้

เมื่อแสดงด้วยแผนผังออร์บิทัลจะเป็นดังนี้

มีผลให้อะตอมของ Na เปลี่ยนเป็น Na+ ในขณะเดียวกันอะตอมของ Cl เปลี่ยนเป็น Cl- แต่การจัดอิเล็กตรอนจะเป็นไปตามกฏออกเต็ตทั้งคู่

แสดงด้วยสมการเคมี จะเป็นดังนี้ ; Na+(g)
+ Cl-(g) → NaCl(s)
ถ้าเป็นกรณีของโลหะกับอโลหะอื่น ๆ ที่ไม่ใช้ธาตุหมู่ 1A จำนวนของอิเล็กตรอนที่ถ่ายเทอาจมากกว่า
1 ในทำนองเดียวกันถ้าเป็นอโลหะอื่นที่ไม่ใช่หมู่ 7A จำนวนอิเล็กตรอนที่รับได้ก็อาจมากกว่า 1
เช่นกัน สังเกตจากภาพต่อไปนี้

จากรูป
แสดงการถ่ายเทอิเล็กตรอนระหว่าง Mg ซึ่งเป็นธาตุหมู่ 2A ซึ่งจะต้องเสียอิเล็กตรอน 2 ตัวไอออนที่เกิดขึ้น คือ
Mg2+ จึงจะเป็นไปตามกฎออกเต็ต แต่
Cl
แต่ละอะตอมจะรับอิเล็กตรอนได้เพียง
1 ตัว จึงต้องใช้ Cl จำนวน
2 อะตอม จากนั้น
Mg2+
จึงรวมตัวกับ 2Cl- เป็นสารไอออนิก MgCl2 เขียนแสดงด้วยสมการเคมี ดังนี้
Mg2+
+ Cl- + Cl- → MgCl2
หรือ Mg2+
+ 2Cl- → MgCl2
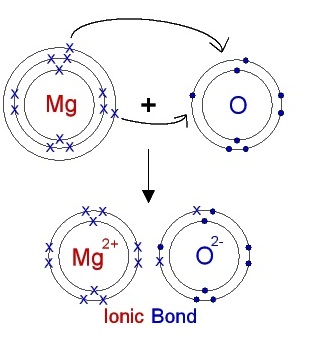
จากรูป
แสดงการถ่ายเทอิเล็กตรอนระหว่าง Mg ซึ่งเป็นธาตุหมู่ 2A ซึ่งจะต้องเสียอิเล็กตรอน 2 ตัวไอออนที่เกิดขึ้น คือ
Mg2+ เป็นไปตามกฎออกเต็ต ในขณะที่ O ซึ่งเป็นธาตุหมู่ 6A จะรับอิเล็กตรอนได้ 2
ตัว จึงใช้ O เพียง
1 อะตอม แต่กลายเป็นไอออน O2- จากนั้นรวมตัวกันเป็น MgO ดังสมการ
Mg2+ + O2- → MgO
ตัวอย่างต่อไปนี้เป็นปฏิกิริยาที่เกิดขึ้นระหว่างอะตอมของ Li กับอะตอมของ
O โดย Li เป็นธาตุหมู่ 1A มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ในขณะที่ O เป็นธาตุหมู่
6A มีเวเลนซ์อิเล็กตรอนเท่ากับ 6 อัตราส่วนในการรวมตัวจะเป็น Li : O = 2:1 ดังรูป

เขียนแสดงด้วยสมการดังนี้ ; 2Li+ + O2- → Li2O
(คลิ้ก ชมและฟังคำอธิบายการเกิดพันธะไอออนิกระหว่างธาตุต่าง
ๆ)
(คลิ้ก ชมการเกิดพันธะไอออนิกระหว่างโลหะกับอโลหะต่าง
ๆ)
(คลิ้ก ชมและฟังคำอธิบายอธิบายการเกิดพันธะชนิดต่าง ๆ)
(คลิ้ก ชมและฟังคำอธิบายแสดงการเกิดพันธะชนิดต่าง
ๆ)
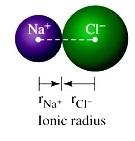
** การที่โลหะกับอโลหะเกิดสารประกอบไอออนิกกันนี้
นำไปใช้ในการบอกขนาดอะตอมที่เรียกว่ารัศมีไอออนิก (ionic radius) ดังรูป
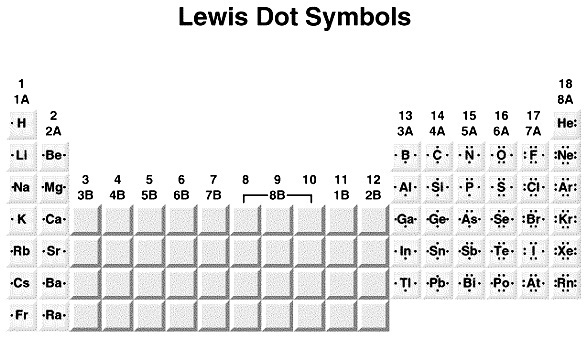
การเกิดปฏิกิริยาของธาตุต่าง ๆ จะเกิดขึ้นที่เวเลนซ์อิเล็กตรอน สำหรับธาตุหมู่ A
แต่ละธาตุจะมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับเลขหมู่ที่ธาตุนั้น ๆ
ถูกจัดเอาไว้
เขียนแสดงด้วยสัญลักษณ์ลิวอิส (Lewis Dot Symbols ) ของแต่ละธาตุในภาวะที่เป็นอะตอมปกติ จะเป็นดังนี้
สารไอออนิกเกิดจากการรวมตัวกันระหว่างไอออนบวกของโลหะกับไอออนลบของอโลหะ แต่มีข้อยกเว้นคือ Be ซึ่งเป็นโลหะหมู่
2A แต่พบว่าสารประกอบที่เกิดขึ้นไม่เป็นสารไอออนิก (เป็นสารโคเวเลนต์) เช่น BeCl2 ขณะเดียวกันมีไอออนของอโลหะอยู่ 1
ชนิด คือ NH4+ (แอมโมเนียมไอออน) เมื่อรวมตัวกับไอออนลบแล้วได้สารไอออนิก เช่น NH4Cl (NH4)2SO4 …
อัตราส่วนระหว่างไอออนบวกกับไอออนลบที่จะรวมตัวกันเป็นสารไอออนิกนั้น จะใช้อัตราส่วนที่ทำให้ประจุบวกกับประจุลบหักล้างกันหมดพอดี โดยเราสามรถใช้ค่าของประจุบวกไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนลบ และใช้ค่าประจุลบไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนบวก ดังรูป

สิ่งสำคัญก็คือ เราต้องรู้จักไอออนต่าง ๆ อย่างถูกต้อง คือทราบว่าไอออนแต่ละชนิดมีประจุเท่าไร และมีชื่อเรียกอย่างไร จะช่วยให้เราเขียนสูตรและเรียกชื่อสารไอออนิกได้ถูกต้อง ในการเขียนสูตรของสารไอออนิกนั้นโดยทั่วไปแล้วให้เขียนไอออนบวกหรือไอออนของโลหะเอาไว้หน้าไอออนลบ ไอออนที่ควรทราบดังนี้
|
โลหะหมู่
1A
|
ไอออนที่เกิดขึ้น
|
สูตรลิวอิสของไอออน
|
ชื่อ
|
|
Li
|
Li+
|
[Li]+
|
ลิเทียมไอออน
|
|
Na
|
Na+
|
[Na]+
|
โซเดียมไอออน
|
|
K
|
K+
|
[K]+
|
โพแทสเซียมไอออน
|
|
Rb
|
Rb+
|
[Rb]+
|
รูบิเดียมไอออน
|
|
Cs
|
Cs+
|
[Cs]+
|
ซีเซียมไอออน
|
|
Fr
|
Fr+
|
[Fe]+
|
แฟรนเซียมไอออน
|
|
โลหะหมู่
2A
|
ไอออนที่เกิดขึ้น
|
สูตรลิวอิสของไอออน
|
ชื่อ
|
|
Be
|
-
|
-
|
-
|
|
Mg
|
Mg2+
|
[Mg]2+
|
แมกนีเซียมไอออน
|
|
Ca
|
Ca2+
|
[Ca]2+
|
แคลเซียมไอออน
|
|
Sr
|
Sr2+
|
[Sr]2+
|
สตรอนเตียมไอออน
|
|
Ba
|
Ba2+
|
[Ba]2+
|
แบเรียมไอออน
|
|
Ra
|
Ra2+
|
[Ra]2+
|
เรเดียมไอออน
|
*** เนื่องจาก Be มีการจัดอิเล็กตรอนคล้าย He มีอิเล็กตรอนเต็มทุกออร์บิทัล จึงมีความเสถียรมาก เสียอิเล็กตรอนยาก จึงไม่เป็นไอออน ทำให้ไม่เกิดสารประกอบไอออนิก เปรียบเทียบการจัดอิเล็กตรอนกับฮีเลียมได้ดังนี้

|
โลหะหมู่
3A
|
ไอออนที่เกิดขึ้น
|
สูตรลิวอิสของไอออน
|
ชื่อ
|
|
B(เป็นธาตุกึ่งโลหะ)
|
-
|
-
|
-
|
|
Al
|
Al3+
|
[Al]3+
|
อลูมิเนียมไอออน
|
|
Ga
|
Ga3+
|
[Ga]3+
|
แกลเลียมไอออน
|
|
In
|
In3+
|
[In]3+
|
อิเดียมไอออน
|
|
Tl
|
Tl3+
|
[Tl]3+
|
แทลเลียมไอออน
|
สำหรับธาตุหมู่ 4A มีทั้งอโลหะ กึ่งโลหะและอโลหะ โดยในส่วนที่เป็นโลหะได้แก่ Sn Pb สามารถเกิดไอออนได้ธาตุละ
2 ชนิด ดังนี้
|
โลหะหมู่
4A
|
ไอออนที่เกิดขึ้น
|
สูตรลิวอิสของไอออน
|
ชื่อ
|
|
C(อโลหะ)
|
-
|
|
-
|
|
Si(กื่งโลหะ)
|
-
|
|
-
|
|
Ge(กึ่งโลหะ)
|
-
|
|
-
|
|
Sn(โลหะ)
|
Sn2+
Sn4+
|
[Sn]2+
[Sn]4+
|
ทิน(II)ไอออน
ทิน(IV)ไอออน
|
|
Pb(โลหะ)
|
Pb2+
Pb4+
|
[Pb]2+
[Pb]4+
|
เลด(II)ไอออน
เลด(IV)ไอออน
|
สำหรับโลหะแทรนซิชัน
พบว่าส่วนใหญ่แต่ละธาตุจะเกิดไอออนได้หลายชนิด เช่น
|
โลหะแทรนซิชัน
|
ไอออนของโลหะแทรนซิชัน
|
สูตรลิวอิสของไอออน
|
ชื่อ
|
|
Sc
|
Sc+
|
[Sc]+
|
สแกนเดียม(I)ไอออน
|
|
Sc2+
|
[Sc]2+
|
สแกนเดียม(II)ไอออน
|
|
Sc3+(พบมากที่สุด)
|
[Sc]3+
|
สแกนเดียม(III)ไอออน
|
|
Ti
|
Ti2+
|
[Ti]2+
|
ไททาเนียม (II)ไอออน
|
|
Ti3+
|
[Ti]3+
|
ไททาเนียม (III)ไอออน
|
|
Ti4+(พบมากที่สุด)
|
[Ti]4+
|
ไททาเนียม (III)ไอออน
|
|
V
|
V2+
|
[V]2+
|
วาเนเดียม(II)ไอออน
|
|
V3+
|
[V]3+
|
วาเนเดียม(III)ไอออน
|
|
V4+
|
[V]4+
|
วาเนเดียม(IV)ไอออน
|
|
V5+
|
[V]5+
|
วาเนเดียม(V)ไอออน
|
|
Cr
|
Cr2+
|
[Cr]2+
|
โครเมียม(II )ไอออน
|
|
Cr3+
|
[Cr]3+
|
โครเมียม( III)ไอออน
|
|
Cr6+
|
[Cr]6+
|
โครเมียม( VI)ไอออน
|
|
Mn
|
Mn2+
|
[Mn]2+
|
แมงกานีส( II )ไอออน
|
|
Mn3+
|
[Mn]3+
|
แมงกานีส( III )ไอออน
|
|
Mn4+
|
[Mn]4+
|
แมงกานีส( IV )ไอออน
|
|
Mn7+
|
[Mn]6+
|
แมงกานีส( VII )ไอออน
|
|
Fr
|
Fe2+
|
[Fe]2+
|
ไอร์ออน( II )ไอออน
|
|
Fe3+
|
[Fe]3+
|
ไอร์ออน( III )ไอออน
|
|
Co
|
Co2+
|
[Co]2+
|
โคบอลต์( II )ไอออน
|
|
Co3+
|
[Co]3+
|
โคบอลต์( III )ไอออน
|
|
Ni
|
Ni2+
|
[Ni]2+
|
นิกเกิล(II)ไอออน
|
|
Cu
|
Cu+
|
[Cu]+
|
คอปเปอร์( I ) ไอออน
|
|
Cu
|
Cu2+
|
[Cu]2+
|
คอปเปอร์( II) ไอออน
|
|
Zn
|
Zn2+
|
[Zn]2+
|
ซิงค์ไอออน
|
|
Hg
|
Hg+
|
[Hg]+
|
เมอร์คิวรี ( I )ไอออน
|
|
Hg
|
Hg2+
|
[Hg]2+
|
เมอร์คิวรี( II )ไอออน
|
อโลหะเมื่อเป็นไอออน จะเป็นไอออนลบ ดังนี้

นอกจากนี้แล้วยังมีไอออนที่มีลักษณะเป็นกลุ่มอะตอม (poly atomic ion) อีกเป็นจำนวนมาก ที่ควรทราบมีดังนี้
|
ไอออนที่เป็นกลุ่มอะตอม
|
ชื่อ
|
ไอออนที่เป็นกลุ่มอะตอม
|
ชื่อ
|
|
NH4+
|
แอมโมเนียมไอออน
|
MnO4-
|
เปอร์แมงกาเนตไอออน
|
|
CN-
|
ไซยาไนด์ไอออน
|
Cr2O72-
|
ไดโครเมตไอออน
|
|
NO2-
|
ไนไตรต์ไอออน
|
CrO42-
|
โครเมตไอออน
|
|
NO3-
|
ไนเตรตไอออน
|
[Fe(CN)6]3-
|
เฮกสะไซยาโนเฟอร์เรต(III)ไอออน
|
|
HSO4-
|
ไฮโดรเจนซัลเฟตไอออน
|
AsO43-
|
อาร์ซิเนตไอออน
|
|
SO42-
|
ซัลเฟตไอออน
|
BO33-
|
โบเรต
|
|
SO32-
|
ซัลไฟต์ไอออน
|
B2O54−
|
ไดโบเรต
|
|
S2O32-
|
ไทโอซัลเฟตไอออน
|
ClO-
|
ไฮโปคลอไรต์ไอออน
|
|
H2PO4-
|
ไดไฮโดรเจนฟอสเฟตไอออน
|
ClO2-
|
คลอไรต์ไอออน
|
|
HPO42-
|
ไฮโดรเจนฟอสเฟตไอออน
|
ClO3-
|
คลอเรตไอออน
|
|
PO43-
|
ฟอสเฟตไอออน
|
ClO4-
|
เปอร์คลอเรตไอออน
|
|
HCO3-
|
ไฮโดรเจนคาร์บอเนตไอออน
|
OH-
|
ไฮดรอกไซดด์ไอออน
|
|
CO32-
|
คาร์บอเนตไอออน
|
SiO32-
|
ซิลิเคทไอออน
|
การเขียนสูตรแบบลิวอิสของสารไอออนิก
สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบ ฉะนั้นในการเขียนสูตรแบบลิวอิสจึงเป็นการเขียนแสดงจำนวนไอออนบวกและไอออนลบ ที่ประกอบเป็นสารไอออนิกนั้น ๆ
สังเกตจากตัวอย่างต่อไปนี้

การเรียกชื่อสารประกอบไอออนิก
หลักการเรียกชื่อสารไอออนิกมีดังนี้
1. สารไอออนิกที่เกิดจากโลหะหมู่ A
รวมทั้ง NH4+ ให้เรียกชื่อไอออนบวกก่อน แล้วตามด้วยชื่อ
ไอออนลบ โดยไม่ต้องบอกจำนวนไอออน เช่น
NaCl เรียกชื่อว่า
โซเดียมคลอไรด์
Na2S เรียกชื่อว่า
โซเดียมซัลไฟด์
Ca(NO3)2 เรียกชื่อว่า แคลเซียมไนเตรต
CaSO4 เรียกชื่อว่า แคลเซียมซัลเฟต
2. สารไอออนิกที่เกิดจากโลหะหมู่
B หรือโลหะแทรนซิชัน ให้เรียกชื่อไอออนบวกคือชื่อของโลหะ
แทรนซิชันก่อน แต่เนื่องจากโลหะแทรนซิชันส่วนมากมีเลขออกซิเดชันหลายค่า จึงกำหนดให้บอกเลขออกซิเดชันของธาตุแทรนซิชันด้วยเลขโรมันไว้ในวงเล็บ โดยแทรกอยู่ระหว่างชื่อของธาตุแทรนซิชันนั้น
ๆ กับชื่อของไอออนลบ เช่น
FeSO4 เกิดจาก Fe2+ + SO42- เรียกชื่อว่า ไอร์ออน (II) ซัลเฟต
Fe(NO3)3
เกิดจาก Fe3+
+ 3NO3- เรียกชื่อว่า ไอร์ออน (III) ไนเตรต
Fe2O3 เกิดจาก 2Fe3+ + 3O2-
เรียกชื่อว่า ไอร์ออน (III) ออกไซด์
Fe3O4 เกิดจาก Fe2+
+ 2Fe3+ + 4O2- เรียกชื่อว่า ไอร์ออน
(II,III) ออกไซด์
(คลิ้ก ฝึกเขียนสูตรของสารไอออนิกจากชื่อของสารที่กำหนด)
รูปภาพที่เกี่ยวข้อง

Size : 33.11 KBs
Upload : 2012-11-16 21:25:15
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|