พันธะเคมี ตอนที่ 7 สารโคเวเลนต์ที่ไม่เป็นไปตามกฎออกเต็ต
พันธะโคเวเลนต์ที่ไม่เป็นไปตามกฎออกเตต
แม้ว่าเราจะใช้กฎออกเตตในการอธิบายการสร้างพันธะเคมีในรูปแบบต่าง ๆ
มาแล้ว แต่พบว่าธาตุบางธาตุสร้างพันธะโดยไม่เป็นไปตามกฎออกเตต
แสดงว่าเราไม่สามารถใช้กฎออกเต็ตอธิบายการสร้างพันธะของธาตุทั้งหมดได้ พบว่าบางธาตุมีการสร้างพันธะทั้งที่เป็นและไม่เป็นไปตามกฎออกเตต เช่น
ฟอสฟอรัส ( P ) เมื่อสร้างพันธะกับคลอรีนจะเกิดสารประกอบ 2
ชนิดคือ PCl3 ชนิดนี้เป็นไปตามกฎออกเต็ต แต่
PCl5
ไม่เป็นไปตามกฎออกเต็ต ดังรูป
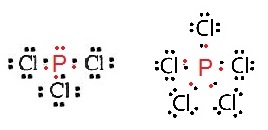
ข้อยกเว้นของสารที่ไม่เป็นไปคามกฎออกเต็ตมีดังนี้
1. โมเลกุลที่มีจำนวนเวเลนซ์อิเล็กตรอนของทุกอะตอมรวมกันเป็นเลขคี่
เช่น ClO2 มีเวเลนซ์อิเล็กตรอนรวมทั้งหมด =
19 เป็นดังรูป

สังเกตที่ Cl จะพบว่ามีเวเลนซ์อิเล็กตรอนเพียง 7
ตัว ยังไม่ครบ 8
NO มีเวเลนซ์อิเล็กตรอนรวมทั้งหมด = 11 เป็นดังรูป

สังเกตที่ N จะพบว่ามีเวเลนซ์อิเล็กตรอนเพียง 7
ตัว ยังไม่ครบ 8
NO2 มีเวเลนซ์อิเล็กตรอนรวมทั้งหมด = 17 เป็นดังรูป
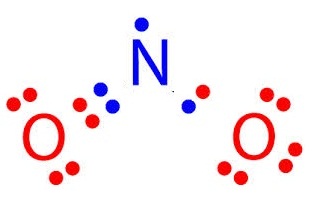
สังเกตที่ N จะพบว่ามีเวเลนซ์อิเล็กตรอนเพียง 7
ตัว ยังไม่ครบ 8
2. โมเลกุลที่ Be และ B เป็นอะตอมกลาง จะมีเวเลนซ์อิเล็กตรอนน้อยกว่า 8 เป็นดังรูป

สังเกตที่ Be จะพบว่ามีเวเลนซ์อิเล็กตรอนเพียง 4 ตัว
ยังไม่ครบ 8
สังเกตที่ B จะพบว่ามีเวเลนซ์อิเล็กตรอนเพียง 6 ตัว ยังไม่ครบ 8
อธิบายเพิ่มเติมกรณีของ
Be
การจัดอิเล็กตรอนของ Be ในภาวะปกติเป็นดังนี้
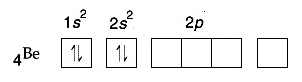 จะเห็นได้ว่าการจัดอิเล็กตรอนของ Be ในภาวะปกติเป็นการจัดเต็มทุกออร์บิทัล อะตอมของ Be จึงเสถียรเพราะมีเวเลนซ์อิเล็กตรอน
= 2 คล้าย ๆ He แต่อย่างไรก็ตามยังมีออร์บิทัล 2p ว่างอยู่
จึงกระตุ้นให้เกิดไฮบริไดเซชัน
sp ขึ้นมาได้ ดังรูป จะเห็นได้ว่าการจัดอิเล็กตรอนของ Be ในภาวะปกติเป็นการจัดเต็มทุกออร์บิทัล อะตอมของ Be จึงเสถียรเพราะมีเวเลนซ์อิเล็กตรอน
= 2 คล้าย ๆ He แต่อย่างไรก็ตามยังมีออร์บิทัล 2p ว่างอยู่
จึงกระตุ้นให้เกิดไฮบริไดเซชัน
sp ขึ้นมาได้ ดังรูป
 เมื่อเกิดไฮบริดออร์บิทัล ทำให้ Be สร้างพันธะกับอะตอมอื่น ๆ เช่น Cl ด้วย σ bond ได้
2 พันธะ กลายเป็น BeCl2 ดังรูป เมื่อเกิดไฮบริดออร์บิทัล ทำให้ Be สร้างพันธะกับอะตอมอื่น ๆ เช่น Cl ด้วย σ bond ได้
2 พันธะ กลายเป็น BeCl2 ดังรูป

ผลจากสร้างพันธะของ Be ทำให้มีเวเลนซ์อิเล็กตรอน = 4
ยังไม่ครบ 8
แต่ก็ไม่สามารถสร้างพันธะต่อไปได้อีกแล้ว
จึงถือว่าเป็นกรณียกเว้นของกฎออกเต็ต
อธิบายเพิ่มเติมกรณีของ B
กรณีของ B มีเวเลนซ์อิเล็กตรอน = 3 เมื่ออยู่ในภาวะปกติจะมีการจัดอิเล็กตรอนในออร์บิทัล ดังรูป
 สังเกตที่ p ยังมีออร์บิทัลว่างอยู่ 2
ออร์บิทัล คือ 2Py และ 2Pz จึงกระตุ้นให้เกิดไฮบริไดเซชัน ได้
ดังรูป สังเกตที่ p ยังมีออร์บิทัลว่างอยู่ 2
ออร์บิทัล คือ 2Py และ 2Pz จึงกระตุ้นให้เกิดไฮบริไดเซชัน ได้
ดังรูป
 
เมื่อเกิดไฮบริดออร์บิทัล sp2 ทำให้ B สร้างพันธะกับอะตอมอื่น ๆ เช่น Cl ด้วย σ bond ได้ 3 พันธะ กลายเป็น BCl3 ดังรูป
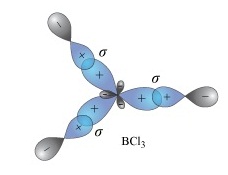
ผลจากสร้างพันธะของ B ทำให้มีเวเลนซ์อิเล็กตรอน = 6
ยังไม่ครบ 8
แต่ก็ไม่สามารถสร้างพันธะต่อไปได้อีกแล้ว
จึงถือว่าเป็นกรณียกเว้นที่ไม่เป็นไปตามกฎออกเต็ตเช่นกัน
3. โมเลกุลที่อะตอมกลางมีอิเล็กตรอนมากกว่า 8 ส่วนใหญ่จะเกิดขึ้นกับอะตอมกลางที่มีเวเลนซ์อิเล็กตรอนใกล้จะ
ครบ
8 หรือครบ 8
อยู่แล้ว
แต่มีการเกิดไฮบริไดเซชันจนทำให้มีไฮบริดออร์บิทัลมากกว่า 4 ออร์บิทัล เช่น
SF4 SF6 PF5 XeF4 XeF6 ดังรูป
 
การเกิดสารประกอบเหล่านี้
อธิบายได้จากการเกิดไฮบริไดเซชัน ดังต่อไปนี้
- กรณีของ SF4 และ SF6 พิจารณาที่ S จะเห็นว่ามีเวเลนซ์อิเล็กตรอน 10
และ 12 ตามลำดับ
การจัดอิเล็กตรอนของ
S
ในภาวะปกติเป็นดังนี้
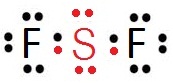
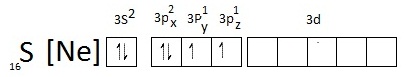 สังเกตที่ sudshell 3p มีอิเล็กตรอนเดี่ยวอยู่ที่ 3Py และ 3Pz ฉะนั้นถ้า S จะสร้างพันธะกับอะตอมอื่น ๆ เช่น F ในขณะที่อะตอมอยู่ในภาวะปกติ ก็จะได้สาร SF2 ซึ่งเป็นไปตามกฎออกเต็ด ดังรูป สังเกตที่ sudshell 3p มีอิเล็กตรอนเดี่ยวอยู่ที่ 3Py และ 3Pz ฉะนั้นถ้า S จะสร้างพันธะกับอะตอมอื่น ๆ เช่น F ในขณะที่อะตอมอยู่ในภาวะปกติ ก็จะได้สาร SF2 ซึ่งเป็นไปตามกฎออกเต็ด ดังรูป
 แต่เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้ แต่เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้

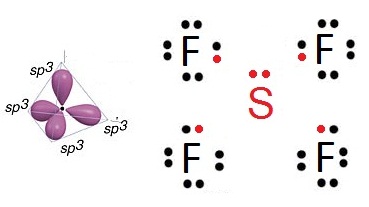
ผลจากการเกิดไฮบริไดเซชัน ทำให้เกิดไฮบริดออร์บิทัลได้หลายแบบ ถ้าเลือกเพียง 2 แบบ คือ sp3 และ sp3d2 จะเป็นดังรูป

เมื่อเกิดไฮบริดออร์บิทัลชนิด sp3
จะเกิดสารประกอบ SF4 ดังรูป
กรณีนี้จะเห็นว่าทำให้ s
มีเวเลนซ์อิเล็กตรอน = 10
เมื่อเกิดไฮบริดออร์บิทัลชนิด sp3d2 จะเกิดสารประกอบ SF6 ดังรูป

กรณีนี้จะเห็นว่าทำให้ s
มีเวเลนซ์อิเล็กตรอน = 12
(คลิ้ก ชมลักษณะโมเลกุลของ SF6)
- กรณีของ P พบว่าการจัดอิเล็กตรอนของ P
ในภาวะปกติเป็นดังนี้
 เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้ เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้
 เมื่อเกิดไฮบริดออร์บิทัลชนิด sp2 จะเกิดสารประกอบที่เป็นไปตามกฏออกเต็ต
เช่น PCl3 ดังรูป เมื่อเกิดไฮบริดออร์บิทัลชนิด sp2 จะเกิดสารประกอบที่เป็นไปตามกฏออกเต็ต
เช่น PCl3 ดังรูป

เมื่อเกิดไฮบริดออร์บิทัลชนิด sp3d จะเกิดสารประกอบที่เป็นไปตามกฏออกเต็ต
เช่น PCl5 ดังรูป

(คลิ้ก ชมโครงสร้างโมเลกุลของ PCl5)
- กรณีของ Xe ซึ่งเป็นธาตุหมู่ 8A เมื่ออะตอมอยู่ในภาวะปกติ จะมีการจัดอิเล็กตรอนดังนี้

จะเห็นได้ว่ามีเวเลนซ์อิเล็กตรอน = 8 อยู่ที่ระดับพลังงาน n=5
เป็นไปตามกฎออกเต็ตอยู่แล้ว
ฉะนั้นในภาวะปกติจึงไม่ทำปฏิกิริยาหรือสร้างพันธะกับอะตอมอื่น ทำให้เรียกว่าก๊าซเฉื่อย แต่สังเกตที่ subshell 5d ยังว่างอยู่ ฉะนั้นเมื่อถูกกระตุ้นจะเกิดไฮบริไดเซชัน ดังรูป
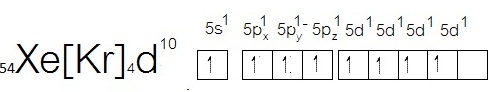
จากไฮบริไดเซชันที่เกิดขึ้นนี้สามารถเกิดไฮบริดออร์บิทัลได้หลายแบบ ถ้าเลือกแสดงเพียง 2
แบบ คือ sp3 และ sp3d2 จะเป็นดังนี้
ถ้าเกิดไฮบริดออร์บิทัลแบบ sp3
จะสร้างพันธะกับธาตุอื่น เช่น F ได้ 4 พันธะ ได้สารประกอบ XeF4ดังนี้

สังเกตที่ Xe
จะเห็นได้ว่ามีเวเลนซ์อิเล็กตรอน = 12
ถ้าเกิดไฮบริดออร์บิทัลแบบ sp3d2
จะสร้างพันธะกับธาตุอื่น เช่น F ได้ 6 พันธะ ได้สารประกอบ XeF6ดังนี้

สังเกตที่ Xe จะเห็นได้ว่ามีเวเลนซ์อิเล็กตรอน = 14
สิ่งที่น่าสังเกตคือ N กับ P เป็นธาตุหมู่
5A
เช่นเดียวกัน
แต่เมื่อเกิดสารประกอบแล้วพบว่าต่างกัน
เช่น เมื่อทำปฏิกิริยากับ Cl ธาตุ
N จะเกิดสาร NCl3 อย่างเดียว ซึ่งเป็นไปตามกฎออกเตต ในขณะที่ P จะเกิดสาร PCl3 ซึ่งเป็นไปตามกฎออกเตต แต่ขณะเดียวกันจะเกิด PCl5 ได้ด้วย
แต่ไม่เป็นไปตามกฎออกเตต คือใน PCl5 มีเวเลนซ์อิเล็กตรอนของ P = 10
ดังรูป

แบบฝึกหัด
1. What types of
hybrid orbitals are involved in bonding of SO42-? (Ans.e)
(ในสาร SO42- มีไฮบริดออร์บิทัลชนิดใด)
a)
sp2 b)
d2sp3 c)
sp d)
dsp3 e) sp3
2. What types of
hybrid orbitals are involved in bonding of SiF62-?
(Ans.e)
(ในสาร SiF62 - มีไฮบริดออร์บิทัลชนิดใด)
a)
sp2 b)
dsp3 c)
sp3 d)
sp e) sp3
d2
3. What types of hybrid orbitals are involved in
bonding of XeF2? (Ans.c)
(ในสาร XeF2 มีไฮบริดออร์บิทัลชนิดใด)
a)
sp b)
sp3 d2 c)
sp d) sp3
e) dsp3
4. What types of hybrid orbitals are involved in
bonding of XeF4? (Ans.c)
(ในสาร XeF4 มีไฮบริดออร์บิทัลชนิดใด)
a)
dsp3 b)
sp2 c)
sp3
d) sp e) d2sp3
5. What types of hybrid orbitals are involved in
bonding of BrF5? (Ans.a)
(ในสาร BrF5 มีไฮบริดออร์บิทัลชนิดใด)
a)
sp3d b)
sp c) sp2
d) sp3
e) d2sp3
6. What types of hybrid orbitals are involved in
bonding of BF4-?(Ans.e)
(ในสาร BF4- มีไฮบริดออร์บิทัลชนิดใด)
a)
d2sp3 b)
dsp3 c)
sp d) sp2
e) sp3
7. What types of hybrid orbitals are involved in
bonding of SO32-? (Ans.e)
(ในสาร SO32- มีไฮบริดออร์บิทัลชนิดใด)
a) sp2 b) sp c) sp3 d) dsp3 e) sp3d2
8. What types of hybrid orbitals are involved in
bonding of ClO3-?(Ans.e)
(ในสาร
ClO3- มีไฮบริดออร์บิทัลชนิดใด)
a)
sp2 b)
sp c) sp3
d) dsp3
e)
sp3d2
9. Draw Lewis Structures for the following molecules:
(จงเขียนโครงสร้างลิวอิสของโมเลกุลต่าง
ๆ ดังที่กำหนดให้ต่อไปนี้)
a. BeCl2 b.
BF3 c.
PF5
d. PCl5 e. SF6 f. TeF6
10. Indicate the hybridization of the central
atom. Also indicate the total number of
sigma () and pi (π)
bonds in the following molecules.
(
จงพิจารณาว่าอะตอมกลางของแต่ละโมเลกุลต่อไปนี้
มีไฮบริไดเซชันแบบใด พร้อมระบุด้วยว่ามี bonds และ
π bonds อย่างละเท่าไร)
|
Formula
|
Hybridization of central atom
|
number of sigma () bonds
|
number of pi (π) bonds
|
|
CO2
|
sp
|
|
|
|
BeCl2
|
sp
|
|
|
|
BF3
|
sp2
|
|
|
|
CCl4
|
sp3
|
|
|
|
NO3-
|
sp2
|
|
|
|
SO3
|
sp2
|
|
|
|
SO32-
|
sp3
|
|
|
|
O3
|
sp2
|
|
|
|
CO32-
|
S
p2
|
|
|
11. Phosphorus and nitrogen are
both in Group V. PCl3 and PCl5 both exist. NCl3 exists, but NCl5 is an
unstable compound. Why? ( P และ
N ต่างก็เป็นธาตุหมู่ 5A เช่นเดียวกัน
แต่ปรากฏว่า P เกิดสารประกอบ
PCl3 และ PCl5 ได้ทั้ง
2 ชนิด แต่ N เกิดได้เฉพาะ
NCl3
อย่างเดียว
อยากทราบว่าเป็นเพราะเหตุใด)
12. Draw Lewis
structures for the following compounds. If they exhibit resonance, draw all of the resonance
structures.
(จงเขียนโครงสร้างลิวอิสของสารที่กำหนดให้ต่อไปนี้ ถ้ามีเรโซแนนให้เขียนแสดงเรโซแนนซ์ด้วย)
a. XeO2F2 b. SCl6 c. KrF2
13. Draw the simplified Lewis structure for each of the
following molecules.
(จงเขียนโครงสร้างลิวอิสของสารที่กำหนดให้ต่อไปนี้)
(a) ICl5 (b)
RnCl2
14. Draw the simplified Lewis structure for each of the
following.
(จงเขียนโครงสร้างลิวอิสของสารที่กำหนดให้ต่อไปนี้)
(a) ClF3 (b)
NO+ (c)
ICl4-
15. Draw the
Lewis structure of the molecule with molecular formula ICl3.
(จงเขียนโครงสร้างลิวอิสของ ICl3)
16. Draw Lewis Dot structures for: (จงเขียนโครงสร้างลิวอิสของสารต่อไปนี้)
a. ICl4- b. XeO3
c. ClF3 d.
RnCl2
รูปภาพที่เกี่ยวข้อง

Size : 2.79 KBs
Upload : 2012-11-16 21:07:06
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|







 จะเห็นได้ว่าการจัดอิเล็กตรอนของ Be ในภาวะปกติเป็นการจัดเต็มทุกออร์บิทัล อะตอมของ Be จึงเสถียรเพราะมีเวเลนซ์อิเล็กตรอน
= 2 คล้าย ๆ He แต่อย่างไรก็ตามยังมีออร์บิทัล 2p ว่างอยู่
จึงกระตุ้นให้เกิดไฮบริไดเซชัน
sp ขึ้นมาได้ ดังรูป
จะเห็นได้ว่าการจัดอิเล็กตรอนของ Be ในภาวะปกติเป็นการจัดเต็มทุกออร์บิทัล อะตอมของ Be จึงเสถียรเพราะมีเวเลนซ์อิเล็กตรอน
= 2 คล้าย ๆ He แต่อย่างไรก็ตามยังมีออร์บิทัล 2p ว่างอยู่
จึงกระตุ้นให้เกิดไฮบริไดเซชัน
sp ขึ้นมาได้ ดังรูป เมื่อเกิดไฮบริดออร์บิทัล ทำให้ Be สร้างพันธะกับอะตอมอื่น ๆ เช่น Cl ด้วย σ bond ได้
2 พันธะ กลายเป็น BeCl2 ดังรูป
เมื่อเกิดไฮบริดออร์บิทัล ทำให้ Be สร้างพันธะกับอะตอมอื่น ๆ เช่น Cl ด้วย σ bond ได้
2 พันธะ กลายเป็น BeCl2 ดังรูป












 เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้
เมื่อเกิดไฮบริไดเซชันจะเป็นดังนี้ เมื่อเกิดไฮบริดออร์บิทัลชนิด sp2 จะเกิดสารประกอบที่เป็นไปตามกฏออกเต็ต
เช่น PCl3 ดังรูป
เมื่อเกิดไฮบริดออร์บิทัลชนิด sp2 จะเกิดสารประกอบที่เป็นไปตามกฏออกเต็ต
เช่น PCl3 ดังรูป








 คะแนนโหวด
คะแนนโหวด

