ปฏิกิริยาไฟฟ้าเคมี (Electrochemistry)
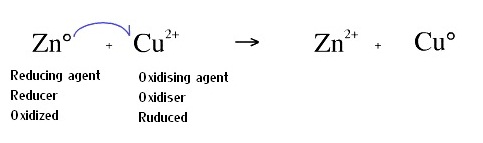
ลักษณะสำคัญของปฏิกิริยาไฟฟ้าเคมีคือการถ่ายเทอิเล็กตรอนระหว่างอนุภาคที่ทำปฏิกิริกัน (ปฏิกิริยาระหว่างกรด-เบส เป็นการถ่ายเทโปรตอนหรือ H+ กัน ) การถ่ายเทอิเล้กตรอนหรือการไหลของอิเล็กตรอนทำให้เกิดการไหลของกระแสไฟฟ้า แต่อย่าลืมว่าอิเล็กตรอนกับกระแสไฟฟ้านั้นไม่ใช่สิ่งเดียวกันแต่สัมพันธ์กัน โดยอิเล็กตรอนกับกระแสไฟฟ้าจะไหลสวนทางกัน ตามที่กล่าวในตอนแรกว่ามีการถ่ายเทอิเล้กตรอนกันก็หมายความว่า อนุภาคหนึ่งเป็นฝ่ายให้อิเล็กตรอนหรือจะเรียกว่าเสียอิเล็กตรอนก็ได้ การเสียอิเล็กตรอนเป็นส่วนหน่ึงของปฏิกิริยาไฟฟ้าเคมี เรียกปฏิกิริยาในการเสียอิเล็กตรอนว่าปฏิกิริยาออกซิเดชัน (oxidation reaction) แต่เรียกอนุภาคที่เกิดปฏิกิริยาออกซิเดชันว่าดัวรีดิวซ์ (reducer , reducing agent) หรือจะเรียกว่าตัวถูกออกซิไดซ์ (oxidised) ก็ได้ ในเวลาเดียวกันอีกอนุภาคหนึ่งก็จะเป็นฝ่ายได้รับอิเล็กตรอน การรับอิเล็กตรอนก็เป็นอีกส่วนหนึ่งของปฏิกิริยาไฟฟ้าเคมี เรียกว่าปฏิกิริยารีดักชัน (reduction reaction) แต่เรียกอนุภาคที่เกิดปฏิกิริยารีดักชันว่าตัวออกซิไดซ์ (oxidiser , oxixising agent) หรือจะเรียกว่าตัวถูกรีดิวซ์ (reduced) ก็ได้ ปฏิกิริยาทั้ง 2 ส่วนที่ว่ามานี้จะเกิดขึ้นพร้อมกัน จึงเรียกชื่อรวมกันว่า รีดักชัน-ออกซิเดชัน (Reduction-reduction reaction) เรียกย่อ ๆ ว่าปฏิกิริยารีดอกซ์ (Redox reaction) เช่น Zn + Cu2+ → Zn2+ + Cu แบ่งออกเป็น 2 ส่วน ดังนี้
1. ปฏิกิริยาออกซิเดชัน (Oxidation reaction) คือส่วนที่อนุภาคเกิดการเสียอิเล็กตรอน ; Zn → Zn2+ + 2e-
Zn เป็นตัวรีดิวซ์ หรือเป็นตัวถูกออกซิไดซ์
2. ปฏิกิริยารีดักชัน (Reduction reaction) คือส่วนที่อนุภาคได้รับอิเล็กตรอน ; Cu2+ + 2e- → Cu
Cu2+ เป็นตัวออกซิไดซ์ หรือเป็นตัวถูกรีดิวซ์

ปฏิกิริยารีดอกซ์กับเลขออกซิเดชัน
ปฏิกิริยารีดอกซ์มีการถ่ายเทอิเล็กตรอนระหว่างตัวรีดิวซ์กับตัวออกซิไดซ์ ผลจากการถ่ายเทอิเล็กตรอนนี้ทำให้มีการเปลี่ยนแปลงเลขออกซิเดชัน ตัวรีดิวซ์จะมีเลขออกซิเดชันเพิ่มขึ้นขณะเดียวกันตัวออกซิไดซ์จะมีเลขออกวิเดชันลดลง
1. ปฏิกิริยาที่ไม่มีการเปลี่ยนแปลงเลขออกซิเดชันของธาตุใด ๆ ไม่ใช่ปฏิกิริยารีดอกซ์
2. ปฏิกิริยาที่บางธาตุมีเลขออกซิเดชันเพิ่มขึ้น แต่ไม่มีธาตุใดที่มีเลขออกซิเดชันลดลงรวมอยู่ด้วย เป็นปฏิกิริยาออกซิเดชัน
3. ปฏิกิริยาที่มีบางธาตุมีเลขออกซิเดชันลดลง แต่ไม่มีธาตุใดที่มีเลขออกซิเดชันเพิ่มขึ้นรวมอยู่ด้วย เป็นปฏิกิริยารีดัชั่น
4. ปฏิกิริยาที่มีทั้งมีธาตุซึ่งเลขออกซิเดชันเพิ่มขึ้นและลดลงอยู่ในสมการเดียวกันเป็นปฏิกิริยารีดอกซ์
(ใครหาเลขออกซิเดชันไม่เป็น คลิ้กที่นี่)
แบบฝึกหัด จงพิจารณาว่าปฏิกิริยาต่อไปนี้เป็นปฏิกิริยารีดอกซ์หรือไม่
1. NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(aq)
2. Ba2+(aq) + SO42-(aq) → BaSO4(s)
3. Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
4. 5Zn(s) + 2KMnO4(aq) + 8H2SO4(aq) → 5ZnSO4(aq) + 2MnSO4(aq) + K2SO4(aq) + 8H2O
5. 2H2 + O2 → 2H2O
6. 2Ag+ + Cu → Cu2+ + 2Ag
รูปภาพที่เกี่ยวข้อง

Size : 424.91 KBs
Upload : 2012-10-27 20:53:29
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|