กรด-เบส ตอนที่ 6 สารละลายบัฟเฟอร์
กรด- เบส
ตอนที่ 6 สารละลายบัฟเฟอร์ (Buffer solution)
สารละลายบัฟเฟอร์ หมายถึง
สารละลายที่มีความสามารถในการควบคุมระดับ pH เอาไว้ได้
เมื่อเติมสารละลายกรดหรือเบสจำนวนที่ไม่มากเกินไป
เมื่อเปรียบเทียบกับน้ำบริสุทธิ์ที่เติมกรดหรือเบสจำนวนเท่ากัน สารละลายที่มีสมบัติเป็นสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น สารละลายบัฟเฟอร์เกิดจากการผสมระหว่างสารละลายกรดอ่อนกับเกลือของกรดอ่อนนั้น หรือสารละลายเบสอ่อนกับเกลือของเบสอ่อนนั้น แม้ว่าสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น แต่ถ้าเติมกรดหรือเบสมากเกินไป สารละลายบัฟเฟอร์ก็จะไม่สามารถควบคุมระดับ pH เอาไว้ได้ตลอด
ในที่สุดจะเสียสมบัติในการเป็นสารละลายบัฟเฟอร์ไป เราเรียกความสามารถในการควบคุมระดับ pH ของสารละลายบัฟเฟอร์ว่า buffer capacity
สารละลายบัฟเฟอร์มี 2
ประเภท
1)
บัฟเฟอร์กรด (Acid buffer solution) เกิดจากสารละลายของกรดอ่อนผสมกับสารละลายเกลือของกรดอ่อนชนิดนั้น สารละลายบัฟเฟอร์ประเภทนี้มี pH < 7 เช่น
CH3COOH (กรดอ่อน) + CH3COONa (เกลือของกรดอ่อน)
HCN (กรดอ่อน) + KCN (เกลือของกรดอ่อน)
H2S(กรดอ่อน) + Na2S
(เกลือของกรดอ่อน)
H2CO3(กรดอ่อน) +
NaHCO3 (เกลือของกรดอ่อน)
2)
บัฟเฟอร์เบส (Basic buffer
solution) เกิดจากสารละลายของเบสอ่อนผสมกับสารละลายเกลือของเบสอ่อนนั้น สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เช่น
NH3 (เบสอ่อน) + NH4Cl
(เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4NO3
(เกลือของเบสอ่อน)
Fe(OH)2 (เบสอ่อน) + FeCl2
(เกลือของเบสอ่อน)
Fe(OH)3 (เบสอ่อน) + FeCl3
(เกลือของเบสอ่อน)
วิธีเตรียมสารละลายบัฟเฟอร์
1.
เตรียมโดยตรงจากการผสมสารละลายของกรดอ่อนกับสารละลายเกลือของกรดอ่อนนั้น หรือผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนนั้น ดังรูป
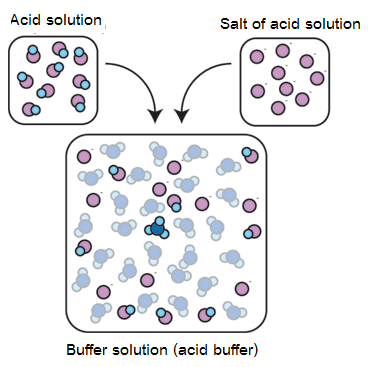
2.
เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
2.1 บัฟเฟอร์กรด
เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส
(แก่หรืออ่อนก็ได้
แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
HF(aq) + NaOH(aq) ↔ NaF(aq) + H2O(l)
(กรดอ่อนมากเกินพอ) (หมด) (เกลือของกรดอ่อนที่เกิดขึ้น)
(มีเหลือ)
ถ้าใช้ HF
มากเกินพอจะมี HF เหลืออยู่
เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไป ในระบบจะเป็นสารละลายผสมระหว่างHF ส่วนที่เหลือ กับ NaF ที่เกิดขึ้น
จึงเป็นบัฟเฟอร์กรด
(กรดอ่อน+เกลือของกรดอ่อนนั้น) ดังรูป
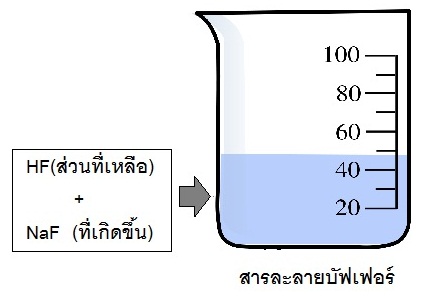
2.2 บัฟเฟอร์เบส
เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ
ทำปฎิกิริยากับสารละลายกรดกรด
(แก่หรืออ่อนก็ได้
แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
HCl(aq)
+ NH4OH(aq) → NH4Cl(aq) + H2O(l)
(หมด) (มากเกินพอ) (เกิดขึ้น)
มีเหลือ
เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปแต่
NH4OH ยังมีเหลือ ฉะนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH สว่นที่เหลือ กับ NH4Cl ที่เกิดขึ้น จึงเป็นสารละลายบัฟเฟอร์เบส (เบสอ่อน + เกลือของเบสอ่อนนั้น)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ส่วนประกอบของสารละลายบัฟเฟอร์
จะแตกต่างจากสารละลายของกรดอ่อนหรือเบสอ่อน คือ
ในสารละลายกรดอ่อนจะมีอนุภาคของกรดอ่อนละลายอยู่มาก แต่อนุภาคของคู่เบสมีน้อย เช่น
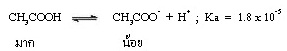
แต่เมื่อผสมสารละลายเกลือของ CH3COOH เช่น CH3COONa ซึ่งเป็นสารไอออนิกที่ละลายน้ำได้ดี แตกตัวเป็นไอออนได้ทั้งหมด จึงมี
CH3COO- อยู่เป็นจำนวนมาก ดังนี้

เมื่อนำมาผสมกันจะมีสมบัติเป็นสารละลายบัฟเฟอร์ ให้สังเกตว่าในสารละลายจะมีกรดอ่อนและคูเบสของกรดอ่อนเป็นจำนวนมากทั้งคู่ ดังสมการ

การที่ในสารละลายมี
กรดอ่อนและคู่เบสของกรดอ่อนนั้นอยู่เป็นจำนวนมาก
ทำให้สามารถควบคุมระดับความเป็นกรด-เบสของสารละลายเอาไว้ได้จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ เพราะ ...
- เมื่อเติมกรด (H+) กรดหรือ H+ ที่เติมลงไปก็จะรวมตัวกับ CH3COO- เกิดปฏิกิริยาย้อนกลับเปลี่ยนให้อยู่ในรูป CH3COOH ได้เกือบทั้งหมด ทำให้ความเข้มข้น H+ เพิ่มขึ้นน้อยกว่า
จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
(คลิ้ก ฃมการควบคุม pH
ของสารละลายบัฟเฟอร์กรด)
- เมื่อเติมเบส (OH-) เบสหรือ OH- ที่เติมลงไปก็จะรวมตัวกับ H+ เปลี่ยนให้มาอยู่ในรูป H2O ทำให้ H+ ลดลงในตอนแรก
แต่ในเวลาเดียวกัน CH3COOH ซึ่งมีอยู่มาก
(สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้
H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH-
ที่เติมลงไปจริง
สำหรับสารละลายบัฟเฟอร์เบสก็จะมีลักษณะเช่นเดียวกัน คือเบสอ่อนแตกตัวได้น้อย เช่น
การละลายของ NH4OH ดังสมการ
;

แต่สำหรับเกลือของเบสชนิดนี้ เช่น NH4Cl จะละลายน้ำได้ดี ดังสมการ
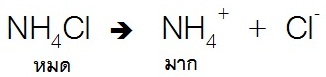
เมื่อผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนเข้าด้วยกัน ในสารละลายที่ได้จากการผสมก็จะมีมากทั้งตัวของเบสอ่อนลัคู่กรดของมัน จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ ดังสมการ

(คลิ้ก ชมการควบคุม pH
ของสารละลายบัฟเฟอร์เบส)
(คลิ้ก ชมการควบคุม pH
ของสารละลายบัฟเฟอร์กรดเมื่อเติมเบสหรือเบส)
การหา pH
ของสารละลายบัฟเฟอร์
1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ

ตัวอย่าง สารละลายบัฟเฟอร์ประกอบด้วย
สารละลายกรดอะซิติกกับสารละลายโซเดียมอะซิเตต
ซึ่งเข้มข้น 0.1 โมล/ลิตรเท่ากันและมีปริมาตร 100 cm3 เท่ากันด้วย ถ้า
Ka
ของกรดอะซิติกเท่ากับ
1.8 x 10-5 จงหา pH ของสารละลายบัปเฟอร์นี้
วิธีทำ

= -log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 + log 1
=
5 – 0.26
=
4.24
2. สารละลายบัฟเฟอร์เบส
หา pH ได้ดังนี้

จากนั้นจึงหา
pH จากสมการ
pH
= 14 – pOH
ตัวอย่าง
สารละลายบัฟเฟอร์ที่เกิดจากผสมสารละลายเบสอ่อน NH4OH และเกลือ NH4Cl ซึ่งมีความเข้มข้น 0.1
โมล/ลิตรเท่ากัน และมีปริมาตร 100cm3 เท่ากันด้วย
ถ้า Kb ของ
NH4OH
เท่ากับ 1.8 x
10-5 สารละลายบัฟเฟอร์นี้มี
pH เท่าไร

= - log 1.8
x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8
+log 1
= 5 – 0.26
= 4.74
pH
= 14 – pOH
= 14 – 4.74
= 9.26
การเตรียมสารละลายบัฟเฟอร์
สารละลายบัฟเฟอร์เป็นสารละลายที่มีราคาแพง ใช้ในงานเฉพาะแต่ละด้าน เช่น ในการปรับเพื่อตั้งค่าให้ถูกต้องของเครื่องมือวิทยาศาสตร์บางชนิด
สารละลายบัฟเฟอร์สำหรับการตั้งค่า
pH
meter ราคา 690
บาท / 500 ml

สารละลายบัฟเฟอร์จะมีค่า pH ต่าง ๆ กัน
การเตรียมสารละลายบัฟเฟอร์ให้มี
pH
ตามที่ต้องการให้ดูจากค่า
pKa ของกรดอ่อน เช่น
ถ้ากรดอ่น HA มีค่า Ka = 1.0 x 10-6 ค่า pKa
= 6 กรดอ่อนชนิดนี้จะเหมาะสำหรับเตรียมสารละลายบัฟเฟอร์ที่มี pH=6

จากสมการจะเห็นว่า [salt] และ [acid] จะมีผลต่อ pH ของสารละลายบัฟเฟอร์ แต่พบว่าถ้า
[salt] = [acid] สารละลายบัฟเฟอร์จะมีคุณภาพดีที่สุด
ถ้า
[salt] = [acid] ; 
= -log
1.0 x 10-6 + log 1
= 6
ถ้า
[salt] = 2เท่าของ [acid]
; 
= -log
1.0 x 10-6 + log 2
= 6.3
ถ้า
[acid] = 2เท่าของ[salt]; 
= -log
1.0 x 10-6 + log 0.5
= 6 - 0.3
= 5.7
แบบฝึกหัด
1.
If 0.010 M NH3 50
cm3 is mixed with 0.100 M NH4Cl 50 cm3 , NH3 has a Kb
=1.8x10-5
(สารละลาย NH3 ความเข้มข้น
0.010 M จำนวน 50
cm3 ผสมกับสารละลาย NH4Cl ความเข้มข้น 0.100 M จำนวน 50 cm3 ; ค่า Kb ของ
MH3 = 1.8x10-5 )
a. setup the
equilibrium expression. (จงเขียนสมการแสดงภาวะสมดุล)
b.
calculate the concentration of OH- produced. (จงคำนวณหาความเข้มข้นของ OH-)
c.
calculate the pOH. (จงคำนวณหาค่า pOH)
d.
Calculate the pH (จงคำนวณหาค่า pH)
2. What is the pH of
a solution of 0.81 M acid and 0.65 M of its conjugate base if the ionization
constant is
4.92 x 10-7? (Ans.c) (สารละลายกรดชนิดหนึ่งมีความเข้มข้น
0.81 M
มีค่า Ka = 4.92 x 10-7
ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น
0.65 M
อยากทราบว่าสารละลายมี pH เท่าไร)
a) 5.80 b) 6.40 c) 6.21
d) 6.81 e)
6.62
3. What is the pH of a solution of 0.28 M
acid and 0.73 M of its conjugate base if the ionization constant is
3.75 x 10-9? (Ans.c) (สารละลายกรดชนิดหนึ่งมีความเข้มข้น
0.28 M มีค่า Ka
= 3.75 x 10-9 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น
0.73 M อยากทราบว่าสารละลายมี pH เท่าไร)
a) 9.58 b) 9.32 c)
8.84 d) 8.01 e)
9.12
4.
What is the pH of a solution of 0.17
M acid and 0.50 M of its conjugate base if the ionization constant is
2.87 x 10-9 ? (Ans.c) (สารละลายกรดชนิดหนึ่งมีความเข้มข้น 0.17 M มีค่า Ka
= 2.87 x 10-9 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น
0.50 M อยากทราบว่าสารละลายมี pH เท่าไร)
a) 9.31 b) 9.59 c)
9.01 d) 9.98 e)
9.71
5. What is the pH of
a solution of 0.73 M acid and 0.40 M of its conjugate base if the pKa = 7.70 ? (Ans.c)
(สารละลายกรดชนิดหนึ่งมีความเข้มข้น 0.73 M มีค่า pKa = 7.70 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.40 M อยากทราบว่าสารละลายมี pH เท่าไร)
a) 8.30 b) 7.15 c) 7.44 d) 7.95 e) 8.15
6. What is the pH of
a solution of 0.28 M acid and 0.54 M of its conjugate base if the pKa = 7.93 ? (Ans.c)
(สารละลายกรดชนิดหนึ่งมีความเข้มข้น 0.28 M มีค่า pKa
= 7.93 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.54 M อยากทราบว่าสารละลายมี pH เท่าไร)
a) 7.40 b) 7.65 c) 8.21 d) 7.00 e) 7.22
7. What is the pH of a solution of 0.65 M acid
and 0.51 M of its conjugate base if the pKa = 5.30 ? (Ans.c)
(สารละลายกรดชนิดหนึ่งมีความเข้มข้น 0.65 M มีค่า pKa
= 5.30 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.51 M อยากทราบว่าสารละลายมี pH เท่าไร)
a) 5.85 b)
5.41 c) 5.19 d) 6.05 e) 5.62
8. What is the
hydronium ion concentration of a solution of 0.260 M acid and 0.640 M of its
conjugate base if the ionization constant is 2.06 x 10-6 ? (Ans.a)
(สารละลายของกรดชนิดหนึ่งความเข้มข้น
0.260 M มีค่า Ka=2.06 x 10-6 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.640 M อยากทราบว่าความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าไร)
a)
8.37 x 10-7 b) 4.21 x 10-7 c)
1.25 x 10-5 d) 2.50 x 10-6 e)
5.07 x 10-6
9.
What is the hydronium ion
concentration of a solution of 0.200 M acid and 0.600 M of its conjugate base
if the ionization constant is 2.88 x 10-7 ? (Ans.a)
(สารละลายของกรดชนิดหนึ่งความเข้มข้น
0.200 M
มีค่า Ka=2.88 x 10-7 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.600 M
อยากทราบว่า
ความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าไร)
a) 9.69 x 10-8
b) 1.73 x 10-7 c)
8.64 x 10-7 d) 5.80 x 10-8 e)
4.67 x 10-7
10. What
is the hydronium ion concentration of a solution of 0.700 M acid and 0.440 M of
its conjugate base if the ionization constant is 3.59 x 10-8 ? (Ans.a)
(สารละลายของกรดชนิดหนึ่งความเข้มข้น 0.700 M มีค่า Ka=3.59 x 10-8 ละลายรวมอยู่กับคู่เบสของมันซึ่งมีความเข้มข้น 0.440 M
อยากทราบว่าความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าไร)
a) 5.71 x 10-8
b) 2.26 x 10-8 c) 2.47 x 10-7 d)
8.98 x 10-8 e) 1.13 x 10-7
11. A buffer solution is formed by adding 0.500
mol of sodium acetate and 0.500 mol of acetic acid to 1.00 L H2O.
What is the pH of the solution at equilibrium?
(Ka = 1.80 x 10-5)
(สารละลายบัฟเฟอร์ 1 ลิตร
เกิดจากโซเดียมอะซิเตตและกรดแอซืติกชนิดละ
0.500 โมล ละลายอยู่รวมกัน อยากทราบว่าจะมี pH เท่าไร
ถ้าค่า Ka ของกรดแอซิติกคือ 1.80 x 10-5)
(A) 5.05 (B) 4.74 (C) 4.44 (D) 2.38 (E) None of these
12.. The
amount (in grams) of sodium acetate (MW = 82.0) to be added to 500.0 mL of
0.200 molar acetic acid (Ka =
1.80 x 10-5)
in order to make a buffer with
pH = 5.000 is
(เมื่อต้องการเตรียมสารละลายบัฟเฟอร์ให้มี
pH 5.00 โดยการเติมโซเดียมอะซิเตต (MW = 82.0) ลงในสารละลายกรดแอซิติกจำนวน 500
ml ความเข้มข้น
0.200 molar อยากทราบว่าจะต้องใช้โซเดียมอะซิเตตกี่กรัม)
(A) 69 (B)
0.180 (C) 14.9
(D) 29.5 (E)
None of these
13. What volumes of 0.500 M HNO2 (Ka = 4.0 X
10-4)
and 0.500 M NaNO2 must be mixed to prepare 1.0 L of a solution
buffered at pH 3.55?
(เมื่อต้องการเตรียมสารละลายบัฟเฟอร์ pH 3.55 จำนวน 1.0 ลิตร จากสารละลาย HNO2 ความเข้มข้น 0.500 M Ka = 4.0 X 10-4 กับสารละลาย NaNO2
ความเข้มข้น
0.500 M เช่นกัน อยากทราบว่าจะต้องใช้สารละลายแต่ละชนิด ปริมาตรเท่าไร)
(A) 500 mL of each solution
(B) 703 mL 0.500 M HNO2, 297 mL 0.500 M NaNO2
(C) 413 mL 0.500 M HNO2, 587 mL 0.500 M NaNO2
(D) 297 mL 0.500 M HNO2, 703 mL 0.500 M NaNO2
(E) 587 mL 0.500 M HNO2, 413 mL 0.500 M NaNO2
14. Which of the following would not make a good
buffering system? (ส่วนประกอบในข้อใดไม่เป็นระบบบัฟเฟอร์ที่ดี)
(A) SO42- and H2SO4
(B) HCO3- and H2CO3
(C) NH3 and NH+4
(D) CH3COO- and CH3COOH
15. If 1.00 L of 1.00 M CH3COOH is mixed with 0.25 mole of solid NaOH
(assume no volume change), what will be the pH of the resulting solution?
(Ka = 1.8 x 10-5).
(เมื่อผสมสารละลาย CH3COOH Ka = 1.8 x 10-5 ความเข้มข้น 1.00 M จำนวน 1.00 L กับ
NaOH จำนวน 0.25 mole เข้าด้วยกัน
โดยสมมติว่าปริมาตรคงที่
อยากทราบว่าสารละลายผสมจะมี pH เท่าไร)
(A) 4. 14 (B) 4.26 (C) 4.74 (D) 5.35
16. Which solution would show the least change in pH upon addition of
3.0 mL of 1.0 M KOH? (Assume equal volumes of each solution are used.
Ka for HC2H3O2 = 1.8 x 10-5)
(ถ้านำสารละลายในแต่ละข้อของตัวเลือกมาในปริมาณที่เท่ากัน แล้วทดลองเติมสารละลาย KOH ความเข้มข้น 1.0 M จำนวน 3.0 mL ลงในแต่ละสารละลาย
อยากทราบว่าชนิดใดที่ pH
เปลี่ยนน้อยที่สุด)
(A) A solution that is 0.50 M acetic acid and
0.50 M sodium acetate.
(B) A solution that is 0.10 M acetic acid and
0.10 M sodium acetate.
(C) A solution that is 1.0 M acetic acid.
(D) A solution that is 0.50 M sodium acetate.
17. What volume of 0.100 M NaOH must be added to
1.00 L of 0.0500 M HA
(Ka = 4.0 x 10-8) to achieve a pH of 8.00?
(มีสารละลายของกรดอ่อน HA (Ka = 4.0
x 10-8) ความเข้มข้น
0.0500M อยู่
1 ลิตร อยากทราบว่าจะต้องเติมสารละลาย NaOH ความเข้มข้น 0.100 M ลงไปกี่ลิตร
เพื่อทำให้สารละลายมี pH=8)
(A) 1.00 L (B) 5.00 L (C) 2.00 L (D)
4.00 L (E) None of these
18. Determine
the pH of a solution in which 1.00 mol H2CO3 (Ka = 4.2 x
10-7)
and 1.00 mole NaHCO3 are dissolved in enough water to form 1.00 L of solution.
(เมื่อใช้ H2CO3 , Ka = 4.2 x
10-7 จำนวน 1.00
โมล ละลายรวมกับ NaHCO3 จำนวน 1.00
โมลเช่นกัน ในสารละลาย 1.00
ลิตร อยากทราบว่าสารละลายมี pH เท่าไร)
19. How
many moles of NaHCO3 should be added to one
liter of 0.100 M H2CO3 (Ka = 4.2 x
10-7) to
prepare a buffer with pH = 7.00?
(มีสารละลาย H2CO3
( Ka = 4.2 x 10-7 ) ความเข้มข้น 0.100 M อยู่ 1
ลิตร
อยากทราบว่าเมื่อต้องการเตรียมสารละลายบัฟเฟอร์ ให้มี
pH=7 จะต้องเติม NaHCO3 ลงไปกี่โมล)
20. Determine the pH of 0.01
M NH3 (Kb= 1.8 x 10-5) when an equal volume of 0.05 M NH4Cl is added.
(สารละลาย NH3 (Kb= 1.8 x 10-5) ความเข้มข้น 0.1M
ถ้าเติมสารละลาย
NH4Cl ความเข้มข้น 0.05M และมีปริมาตรเท่ากันลงไป สารละลายที่ได้จะมี pH เท่าไร)
21. Determine the pH of an HCN/KCN buffer
containing 0.10 mole HCN and 0.07 mole KCN before and after
the addition of 0.001 mol HCl
to one liter of buffer. (Ka = 4.79 x 10-10)
รละลายบัฟเฟอร์ระหว่าง HCN/KCN (Ka = 4.79 x 10-10) จำนวน 1
ลิตร ประกอบด้วย HCN
0.10 mol กับ
KCN 0.07
mol เมื่อเติม HCl ลงไป
0.001 mol อยากทราบว่า pH จะเป็นเท่าไร
22. If 25 mL of 0.2 M NaOH is added to 50 mL of
0.1 M CH3COOH
(Ka = 1.8 x 10-5), what is the pH?
(เมื่อสารละลาย NaOH ความเข้มข้น 0.2M จำนวน 25 mL ผสมกับสารละลาย CH3COOH (Ka = 1.8 x 10-5),
ความเข้มข้น 0.1M จำนวน
50 mL สารละลายที่ได้จากการผสมจะมี
pH เท่าไร)
23. Calculate the mass of (NH4)2SO4 that must be added to 1 L of 0.50 M NH3 in order to prepare a buffer with a pH of
8.65.
(Ka
of NH4+ = 5.6 x 10-10).
(มีสารละลาย NH3 ความเข้มข้น 0.50M อยู่
1 ลิตร
อยากทราบว่าเมื่อต้องการทำให้เป็นสารละลายบัฟเฟอร์ pH 8.65 จะต้องเติม (NH4)2SO4
กี่กรัม ถ้า Ka ของ NH4+ = 5.6 x 10-10 )
24. Calculate the pH of the solution prepared when 0.250 mol HClO4 is added to 2.00 L of a solution that is
0.500 M CH3CO2H and 0.400 M
CH3CO2Na.
(Ka of CH3CO2H = 1.8 x 10-5)
(มีสารละลายอยู่ 2 ลิตร
โดยในสารละลายมี CH3CO2H
และ CH3CO3Na ละลายอยู่รวมกัน มีความเข้มข้น
0.500 และ 0.400
โมลลาร์ ตามลำดับ ค่า Ka ของ CH3CO2H = 1.8 x 10-5
อยากทราบว่าถ้าเติม HClO4 ลงไป 0.250
โมล pH ของสารละลายจะเป็นเท่าไร)
25. A buffer is prepared in which the ratio of
HCO3-/CO32- is 5.00.
(ถ้ามีสารละลายบัฟเฟอร์ซึ่งมีอัตราส่วนระหว่าง HCO3-/CO32- = 5.00. )
(A) What is the pH of this buffer? (Ka for HCO3-
= 4.80 x 10-11)
(สารละลายบัฟเฟอร์นี้มี pH เท่าไร
ถ้า Ka ของ HCO3- = 4.80
x 10-11)
(B) Enough strong acid is added to make the pH
of the buffer 9.30. What is the ratio of HCO3-/CO32- at this point?
(ถ้าเติมกรดแก่ลงไปจนกระทั่งสารละลายมี pH = 9.30
อยากทราบว่าอัตราส่วนระหว่าง HCO3-/CO32- เป็นเท่าไร)
Content's Picture
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|