ปริมาณสารสัมพันธ์ ตอนที่ 9 การคำนวณปริมาณสารจากสมการเคมี(หลักการเบื้องต้น)
การคำนวณปริมาณสารจากสมการเคมี
การเกิดปฏิกิริยาเคมีต่าง ๆ เราเขียนแสดงได้ด้วยสมการเคมี สิ่งที่แสดงอยู่ในสมการเคมีจะประกอบด้วยสารเคมีที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมีนั้น ๆ รวมทั้งภาวะต่าง ๆ
ของการเกิดปฏิกิริยาด้วย สมการเคมีจะช่วยให้เราคิดคำนวณค่าต่าง ๆ ของการเกิดปฏิกิริยาเคมีที่เกิดขึ้น เช่น มวลหรือน้ำหนักของสารเคมีที่ถูกใช้ไป หรือที่เกิดขึ้นใหม่
รวมทั้งการเปลี่ยนแปลงของพลังงานและอื่น ๆ การคำนวณหาปริมาณสารจากสมการเคมีเป็นเรื่องใหญ่และมีความสำคัญอย่างยิ่งต่อการศึกษาวิชาเคมีในขั้นตอนต่อ ๆ ไป
แต่ก่อนอื่นควรทำความเข้าใจเบื้องต้นเกี่ยวกับสิ่งต่อไปนี้ให้ดีเสียก่อน
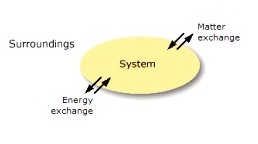
ระบบกับสิ่งแวดล้อม (system and surrounding)
ระบบ หมายถึง สิ่งที่เกิดการเปลี่ยนแปลง โดยอาจเป็นการเปลี่ยนสถานะ การละลายหรือการเกิดปฏิกิริยาเคมีก็ได้
สิ่งแวดล้อม หมายถึง สิ่งที่อยู่รอบ ๆ ของสิ่งที่เกิดการเปลี่ยนแปลงนั้น ซึ่งก็คือทุกสิ่งทุกอย่างที่สัมผัสอยู่กับระบบ

จากรูปเป็นการเผาไหม้ของก๊าซหุงต้ม (LPG =Liquefied Petroleum Gas) เป็นปฏิกิริยาระหว่างก๊าซหุงต้มซึ่งส่วนใหญ่คือโพรเพน (C3H8) กับก๊าซออกซิเจน (O2)
- ระบบ คือ ก๊าซหุงต้มกับก๊าซออกซิเจนที่กำลังเผาไหม้หรือทำปฏิกิริยาเคมีกัน
- สิ่งแวดล้อม คือ ทุกสิ่งทุกอย่างที่อยู่รอบ ๆ การเผาไหม้นี้ เช่น เตาแก๊ส อากาศ ...
กล่าวได้ว่าเมื่อมีการเกิดปฏิกิริยาเคมีใด ๆ ระบบก็คือสารเคมีที่กำลังเกิดปฏิกิริยากันนั้น บรรดาเครื่องมือและอุปกรณ์ที่ใช้ในการทดลอง อากาศ น้ำ และอื่น ๆ ที่อยู่โดยรอบก็คือสิ่งแวดล้อม
(คลิ้ก ชมแอนิเมชันแสดง system & surrounding)
ชนิดของระบบ
เมื่อพิจารณาว่าระบบกับสิ่งแวดล้อมมีความเกี่ยวข้องกันอย่างไรในทางมวลสารและพลังงาน จะจำแนกระบบออกเป็น 3 ประเภท ดังนี้
1. ระบบเปิด (open system) คือระบบที่สามารถถ่ายเทได้ทั้งมวลและพลังงานกับสิ่งแวดล้อม เช่น น้ำร้อนใส่ขวดแล้วเปิดฝาไว้ มีผลให้น้ำในขวดระเหยออกไปได้ ขณะเดียวกันไอน้ำ
จากภายนอกก็สามารถเข้ามาในขวดได้ ส่วนความร้อนนั้นถ่ายเทเข้า-ออกได้อยู่ตลอดเวลา
(คลิ้ก ชมวีดีทัศน์แสดงระบบเปิด)
2. ระบบปิด (closed system) คือระบบที่ไม่ถ่ายเทมวลกับสิ่งแวดล้อม แต่ถ่ายเทพลังงานกันได้ เช่น น้ำร้อนที่ใสขวดแล้วปิดฝาไว้ ทำให้น้ำในขวดไม่สามารถระเหยออกไปได้
ขณะเดียวกันน้ำจากภายนอกก็เข้าไปในขวดไม่ได้เช่นกัน แต่ความร้อนสามารถถ่ายเทเข้า-ออกได้ (ระบบปิดไม่จำเป็นต้องมีฝาปิดเสมอไปก็ได้)
(คลิ้ก ชมวีดีทัศน์แสดงระบบปิด)
3. ระบบอิสสระหรือระบบแยกตัว (isolated system) คือระบบที่จัดทำขึ้นเป็นพิเศษ ป้องกันไม่ให้ถ่ายเททั้งมวลและพลังงานกับสิ่งแวดล้อม เช่น น้ำร้อนที่บรรจุเอาไว้ในกระติกน้ำร้อน
กระติกน้ำร้อนอย่างดีนั้นทำด้วยแก้ว 2 ชั้น ระหว่างชั้นเป็นศูนยากาศป้องกันการพาความร้อน ฉาบด้วยเงินหรือปรอทป้องกันการแผ่รังสีความร้อน ( แคลอริมิเตอร์เป็นเครื่องมือทดลอง
ทางวิทยาศาสตร์ที่มีสมบัติเป็นระบบอิสสระ )
(คลิ้ก ชมวีดีทัศน์แสดงระบบอิสระ)

จากรูป a เป็นระบบเปิด b เป็นระบบปิด และ c และระบบอิสระ
(เนื้อหาเพิ่มเติม)
กฎเบื้องต้นของปริมาณสารสัมพันธ์ (Rules of stoichiometry)
1. กฎทรงมวล (law of conservation of mass)
พ.ศ. 2317 อองตวน โลรอง ลาวัวซิเยร์ (Antoin-Laurent Lavoisier) นักวิทยาศาสตร์ชาวฝรั่งเศสได้ทดลองเผาสารเมอร์คิวรี (II) ออกไซด์ (HgO) ในหลอดปิด
พบว่าสลายตัวได้ปรอทและออกซิเจน ดังสมการ 2HgO (s) → Hg (l) + O2 (g) ผลการทดลองพบว่ามวลของสารทั้งหมดก่อนเกิดปฏิกิริยาเท่ากับมวลของสารทั้งหมดหลังเกิดปฏิกิริยา
และเขาทดลองทำหลายๆ ครั้งก็ได้ผลเช่นเดิม จึงสรุปเป็นกฎเรียกว่า กฎทรงมวล กล่าวว่า “ในปฏิกิริยาเคมีใดๆ มวลของสารทั้งหมดก่อนเกิดปฏิกิริยาเท่ากับมวล
ของสารทั้งหมดหลังเกิดปฏิกิริยา” เช่นเมื่อให้แก๊สไนโตรเจน (H2) 28 กรัมทำปฏิกิริยากับแก๊สออกซิเจน (O2) 32 กรัม จะเกิด NO 60 กรัม
N2(g) + O2(g) → 2NO(g)
2 กรัม + 16 กรัม → 18 กรัม
คลิ้ก ชมแอนิเมชันแสดงปฏิกิริยา N2(g) + O2(g) → 2NO(g)
(คลิ้ก ชมแอนิเมชั่นแสดงกฎทรงมวล)
(คลิ้ก ชมวีดีทัศน์แสดงกฎทรงมวล)
ตัวอย่าง นำโซเดียมซัลเฟต (Na2SO4) 142 กรัม มาทำปฏิกิริยากับแบเรียมคลอไรด์ (BaCl2) 208 กรัม เกิดโซเดียมคลอไรด์ (NaCl) 117 กรัม ถ้าการทดลองนี้เป็นไปตามกฎทรงมวล
ปฏิกิริยาดังกล่าวจะเกิดแบเรียมซัลเฟต (BaSO4) กี่กรัม
วิธีทำ
มวลสารก่อนปฏิกิริยา = มวลสารหลังปฏิกิริยา
โซเดียมซัลเฟต (Na2SO4) + แบเรียมคลอไรด์ (BaCl2) = โซเดียมคลอไรด์ (NaCl) + แบเรียมซัลเฟต (BaSO4)
142 กรัม + 208 กรัม = 117 กรัม + แบเรียมซัลเฟต (BaSO4)
350 กรัม = 117 กรัม + แบเรียมซัลเฟต (BaSO4)
แบเรียมซัลเฟต (BaSO4) = 350 กรัม - 117 กรัม
= 233 กรัม ตอบ
2. กฎสัดส่วนคงที่ (Law of constant Proportions , law of definite proprotion)
พ.ศ. 2345 โจเซฟ เพราสต์ (Joseph Prouste) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้ทำการทดลองและศึกษาปฏิกิริยาเคมีเกี่ยวกับการรวมตัวของธาตุเป็นสารประกอบ
พบว่าอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่ง ๆ จะมีค่าคงที่ ต่อมาได้ตั้งเป็นกฎเรียกว่า กฎสัดส่วนคงที่ กล่าวว่า “เมื่อธาตุตั้งแต่สองชนิดขี้นไปรวมตัวกัน
เกิดเป็นสารประกอบ อัตราส่วนโดยมวลธาตุที่เป็นองค์ประกอบนั้นย่อมมีค่าคงที่เสมอไม่ว่าสารประกอบนั้นจะเตรียมขึ้นโดยวิธีใดหรือจะเตรียมกี่ครั้งก็ตาม”
เช่น เมื่อธาตุไฮโดรเจนรวมตัวกับธาตุออกซิเจนเป็นน้ำ อัตราส่วนโดยมวลของธาตุไฮโดรเจนต่อธาตุออกซิเจนเท่ากับ 1:8 เสมอ ไม่ว่าจะเตรียมน้ำโดยวิธีใดๆ หรือกี่ครั้งก็ตาม ดังตัวอย่าง
|
การทดลอง
|
มวลของธาตุ
ที่ใช้ (กรัม)
|
มวลของธาตุ
ที่เหลือ (กรัม)
|
มวลของ H2O
ที่ได้ (กรัม)
|
อัตราส่วนโดยมวลระหว่าง H:O
|
|
H
|
O
|
H
|
O
|
|
1
|
2
|
16
|
-
|
-
|
18
|
1:8
|
|
2
|
3
|
16
|
1
|
-
|
18
|
1:8
|
|
3
|
4
|
16
|
2
|
-
|
18
|
1:8
|
|
4
|
4
|
32
|
-
|
-
|
36
|
1:8
|
|
5
|
4
|
40
|
-
|
8
|
36
|
1:8
|
|
6
|
4
|
50
|
-
|
18
|
36
|
1:8
|
ตัวอย่าง เมื่อเผากำมะถัน (S) กับโลหะทองแดง (Cu) จะทำปฏิกิริยากันได้ คอปเปอร์ (II) ซัลไฟด์ (CuS) ดังสมการ Cu (s) + S (s) → CuS (s) จงใช้ข้อมูลจากที่กำหนด
ให้คำนวณหาข้อมูลส่วนที่เว้นไว้ โดยให้ถือว่าปฏิกิริยาเป็นไปตามกฎทรงมวลและกฎสัดส่วนคงที่
|
การทดลอง
|
มวลของธาตุ
ที่ใช้ (กรัม)
|
มวลของธาตุ
ที่เหลือ (กรัม)
|
มวลของ CuS
ที่ได้ (กรัม)
|
อัตราส่วนโดยมวลระหว่าง Cu:S
|
|
Cu
|
S
|
Cu
|
S
|
|
1
|
2
|
1
|
-
|
-
|
3
|
2:1
|
|
2
|
3
|
1
|
|
-
|
|
|
|
3
|
4
|
3
|
|
1
|
6
|
|
|
4
|
|
5
|
1
|
-
|
|
|
|
5
|
6
|
6
|
|
|
|
|
(คลิ้ก เพื่อชมวีดีทัศน์เรื่องกฎสัดส่วนคงที่)
3. กฎของเกย์ – ลุสแซก (Gay-Lussac's Law of Combining Gas Volumes))X
ในปี พ.ศ. 2531 โซเซฟ-ลุย-เก-ลูแซก ได้ทดลองวัดปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่ได้จากปฏิกิริยา ณ อุณหภูมิและความดันเดียวกัน แล้วสรุปเป็นกฎการรวม
ปริมาตรของก๊าซ กล่าวว่า ' อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่ได้จากปฏิกิริยา จะมีค่าเป็นเลขจำนวนเต็มลงตัวน้อย ๆ' เช่น H2(g) + Cl2(g) → 2HCl(g)
อัตราส่วนโดยปริมาตรระหว่าง H2(g) : Cl2(g) : 2HCl(g) = 1 : 1 : 2
3H2(g) + N2(g) → 2NH3(g)
อัตราส่วนโดยปริมาตรระหว่าง 3H2(g) : N2(g) : 2NH3(g) = 3: 1 : 2
4. กฎอาโวกาโดร (Avogadro ‘s law)
ในปี พ.ศ. 2354 อาเมเดโอ อาโวกาโดร ได้ศึกษากฎของเกย์-ลูสแซกและอธิบายว่าการที่อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยากันและที่ได้จากปฏิกิริยาเป็นเลขจำนวนเต็มน้อยๆ
เป็นเพราะปริมาตรของก๊าซมีความสัมพันธ์กับจำนวนอนุภาคของก๊าซที่รวมตัวกันเป็นสารประกอบ อาโวกาโดรเสนอสมสุติฐานว่า 'ที่อุณหภูมิและความดันเดียวกัน ก๊าซทุกชนิดที่มีปริมาตรเท่ากัน
จะมีจำนวนโมอนุภาคเท่ากัน' ต่อมาทราบว่าอนุภาคของก๊าซอยู่ในรูปโมเลกุล จึงเสนอเป็นกฎของอาโวกาโดร กล่าวว่า “ ก๊าซที่มีปริมาตรเท่ากัน ที่อุณหภูมิและความดันเดียวกัน
มีจำนวนโมเลกุลเท่ากัน” ต่อมาทราบว่า สารที่มีจำนวนอนุภาคเท่ากันมีจำนวนโมลเท่ากัน จึงอาจกล่าวว่า “ก๊าซที่มีปริมาตรเท่ากัน ที่อุณหภูมิและความดันเดียวกัน มีจำนวนโมลเท่ากัน” เช่น
2H2(g) + O2(g) → 2H2O(g)
|
ปฏิกิริยา
|
2H2(g)
|
+
|
O2(g)
|
→
|
2H2O(g)
|
|
อัตราส่วนโดยปริมาตร
|
2
|
:
|
1
|
:
|
2
|
|
จำนวนอนุภาค
|
2n
|
:
|
n
|
:
|
2n
|
|
จำนวนโมเลกุล
|
2n
|
:
|
n
|
:
|
2n
|
|
จำนวนโมล
|
2n
|
:
|
n
|
:
|
2n
|

หมายเหตุ
- ผลรวมปริมาตรของก๊าซระหว่างก่อนกับหลังปฏิกิริยาจะเท่ากันหรือไม่ก็ได้
- ใช้ตัวเลขแสดงจำนวนโมลของก๊าซจากปฏิกิริยาที่ดุลแล้ว แสดงอัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยาและที่ได้จากปฏิกิริยาที่อุณหภูมิและความดันเดียวกันได้ทันที
เช่น H2(g) +Cl2(g) → 2HCl(g)
อัตราส่วนโดยปริมาตรระหว่าง H2(g) : Cl2(g) : 2HCl (g) = 1: 1 : 2
(ชมวีดีทัศน์กฎของอาโวกาโดร)
Content's Picture

Size : 12.70 KBs
Upload : 2013-08-05 21:56:14
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|