โครงสร้างอะตอม ตอนที่ 9 การจัดอิเล็กตรอนของอะตอม
การจัดอิเล็กตรอนของอะตอม ( Electron
Configuration )
การศึกษาเกี่ยวกับอะตอมมีความก้าวหน้าขึ้นตามลำดับ สามารถคำนวณพลังงานของอิเล็กตรอนได้ จึงทราบว่าอิเล็กตรอนมีพลังงานไม่เท่ากัน ฉะนั้นอิเล็กตรอนที่โคจรอยู่รอบ ๆ นิวเคลียส
จึงมีระยะห่างของวงโคจรไม่เท่ากัน
อิเล็กตรอนที่มีพลังงานต่ำจะโคจรอยู่ในระดับพลังงานต่ำใกล้นิวเคลียส ในขณะที่อิเล็กตรอนที่มีพลังงานสูงขึ้นจะอยู่ในระดับพลังงานสูงซึ่งอยู่ห่างจากนิวเคลียส ออกไปตามลำดับ
ถ้าเราให้พลังงานแก่อะตอมจะมีผลให้อนุภาคต่าง
ๆ ในอะตอมมีพลังงานเพิ่มขึ้นด้วย
อนุภาคที่แสดงผลอย่างชัดเจนคืออิเล็กตรอน
อิเล็กตรอนแต่ละตัวในขณะที่อะตอมอยู่ในภาวะปกติมีพลังงานไม่ เท่ากัน เมื่ออะตอมได้รับพลังงาน อิเล็กตรอนทุกตัวก็ได้รับพลังงานด้วย เมื่ออิเล็กตรอนมีพลังงานสูงขึ้น อย่างเพียงพอ จะมีผลให้ย้ายขึ้นไปอยู่ในระดับพลังงานที่สูงกว่าเดิม หรือกล่าวว่าเป็นการ เปลี่ยนจากภาวะ ground state เป็น excited state แต่อิเล็กตรอนจะไม่หลุดออกไปจากอะตอมง่าย
ๆ เนื่องจากได้รับแรงดึงดูดจากโปรตอนในนิวเคลียส แต่ถ้าให้พลังงานแก่อะตอมจนทำให้ อิเล็กตรอนมี พลังงานสูงมาก จนถึงขั้นเอาชนะแรงดึงดูดที่ได้รับจากโปรตอนในนิวเคลียสแล้ว อิเล็กตรอนก็จะหลุดออกจากอะตอมไป เรียกพลังงานนี้ว่า พลังงานไอออไนเซชัน (
Ionization Energy , IE. ) เมื่อ อะตอมเสียอิเล็กตรอนไปจะกลายเป็นไอออนบวก อิเล็กตรอนตัวแรกที่จะหลุดออกจากอะตอมไปได้ก่อนก็คือเวเลนซ์อิเล็กตรอนตัวที่มีพลังงานสูงที่สุดของอะตอมนั้น
การเสียอิเล็กตรอนดังกล่าวนี้จะเกิดขึ้นเกิดขึ้นในขณะที่อะตอมมีสถานะเป็นแก๊ส และเมื่อเสียอิเล็กตรอนไปแล้วไอออนที่เกิดขึ้นก็ยังคงมีสถานะเป็นแก๊สตามเดิม
ถ้าอะตอมมีอิเล็กตรอนหลายตัวการ เสียอิเล็กตรอนแต่ละตัวจะเกิดขึ้นไม่พร้อมกัน อิเล็กตรอนตัวที่มีพลังงานงานสูงสุดในแต่ละขั้นตอนจะเป็นตัวที่หลุดออกไปจากอะตอมได้ก่อนตัวอื่น ผลจากการเสียอิเล็กตรอนแต่ละตัวจะทำให้อนุภาคที่ เหลือมีประจุบวกเพิ่มขึ้นครั้งละ 1
ประจุ พลังงานที่ทำให้อิเล็กตรอนแต่ละตัวหลุดออกไปจากอะตอม
ก็คือพลังงายไอออไนเซชันของอิเล็กตรอนตัวนั้น ฉะนั้นจำนวนค่าของพลังงาน Ionization Energy , IE จึงมีได้เท่ากับจำนวนอิเล็กตรอนที่อะตอมนั้นมีอยู่ เขียนแสดงค่าโดยมีตัวและกำกับ เช่น IE1 IE2 IE3 ... ให้สังเกตว่าค่า IE1 ( 1st ionization
energy ) ของแต่ละธาตุจะมีค่าต่ำสุด ในบรรดาค่า IE ทั้งหมดของธาตุนั้น ๆ การเสียอิเล็กตรอนที่เกิดขึ้นนี้ถ้าเกิดขึ้นกับอะตอมในภาวะปกติ อะตอมจะเปลี่ยนเป็นไอออนบวกที่มีประจุ 1+ ( หรือจะเขียนเพียงเครื่องหมาย + อย่างเดียว ก็ได้) แต่ถ้าเกิดขึ้นกับ ไอออนบวกก็จะทำให้ไอออนบวกเปลี่ยนเป็นไอออนบวกที่มีประจุบวกมากขึ้นครั้งละ 1
ประจุ คือ + ,
2+ , 3+ …. (การเขียนแสดงประจุของไอออน กำหนดให้เขียน ตัวเลขเอาไว้หน้าเครื่องหมาย +
หรือ -)
(คลิ้ก ชมพลังงานไอออไนเซชันอันดับที่ 1 กับการเสียอิเล็กตรอนของอะตอม)
ตัวอย่าง อลูมีเนียมมีอิเล็กตรอนทั้งหมด 13 ตัว
(13Al) จึงมีโอกาสเสียอิเล็กตรอนได้ 13
ครั้ง มีค่า IE
ได้ 13 ค่า ตั้งแต่ IE1 ถึง
IE13 ดังสมการ
(ตัวที่
1) อิเล็กตรอนตัวนี้คือเวเลนซ์อิเล็กตรอนตัวที่มีพลังงานสูงสุด (ค่า IE ต่ำที่สุด)
Al(g) + IE1
→ Al+(g) + e-
Al(g) + 0.58
MJ mol -1 → Al+(g) + e-
(ตัวที่ 2)
Al+(g) + IE2
→ Al2+(g) + e-
Al+(g) + 1.82
MJ mol -1 → Al2+(g) + e-
(ตัวที่ 3)
Al2+(g) + IE3
→
Al3+(g) + e-
Al2+(g)
+ 2.75 MJ mol
-1 → Al3+(g) + e-
(ตัวที่ 4) (ตัวที่ 4 ถึง 13
ให้เขียนเอง)
Al3+(g) + IE4 → Al4+(g) + e-
Al3+(g)
+ 11.58 MJ mol -1 → Al4+(g) + e-
(ตัวที่
5)
Al4+(g) + IE5 → Al5+(g) + e-
Al4+(g) + 14.83 MJ mol -1 → Al5+(g) + e-
(ตัวที่
6)
Al5+(g) + IE6 → Al6+(g) + e-
Al5+(g)
+ 18.38 MJ mol -1 →
Al6+(g)
+ e-
(ตัวที่
7)
Al6+(g) + IE7 → Al7+(g) + e-
Al6+(g) + 23.30 MJ mol -1 →
Al7+(g)
+ e-
(ตัวที่ 8)
Al7+(g) + IE8
→ Al8+(g) + e-
Al7+(g)
+ 27.46 MJ mol -1 →
Al8+(g)
+ e-
(ตัวที่
9)
Al8+(g) + IE9 → Al9+(g) + e-
Al8+(g)
+ 31.90
MJ mol -1 → Al9+(g) + e-
(ตัวที่
10)
Al9+(g) + IE10 → Al10+(g) + e-
Al9+(g)
+ 38.46
MJ mol -1 → Al10+(g) + e-
(ตัวที่
11)
Al10+(g) + IE11 → Al11+(g) + e-
Al10+(g)
+ 42.66
MJ mol -1 → Al11+(g) + e-
(ตัวที่
12)
Al11+(g) + IE12 → Al12+(g) + e-
Al11+(g) + 201.08 MJ mol -1 →
Al12+(g)
+ e-
(ตัวที่
13) ; ตัวที่อยู่ใกล้นิวเคลียสที่สุด มีพลังงานน้อยที่สุด (ค่า IE สูงที่สุด)
Al12+(g) + IE13
→ Al13+(g) + e-
Al12+(g)
+ 222.32
MJ mol -1 → Al13+(g) + e-
ให้จินตนาการว่าอิเล็กตรอนทั้ง 13 ตัว
ของ Al นั้น ขณะอยู่ในภาวะปกติ
(ground state) แต่ละตัวมีพลังงานไม่เท่ากัน จึงโคจรอยู่ห่างจากนิวเคลียสไม่เท่ากันด้วย
อิเล็กตรอนที่มีพลังงาน มากจะอยู่ห่างจากนิวเคลียสมากกว่าอิเล็กตรอนที่มีพลังงานน้อย อิเล็กตรอนที่อยู่นอกสุด เรียกว่าเวเลนซ์อิเล็กตรอน (valence
clectron)
เป็นอิเล็กตรอนที่มีพลังงานมากที่สุดของอะตอม เมื่อให้ พลังงานแก่อะตอม จะทำให้อิเล็กตรอนทุกตัวมีพลังงานเพิ่มขึ้น (excited
state) พวกที่มีพลังงานมากอยู่แล้วก็จะยิ่งมีพลังงานมากขึ้นอีก
ในที่สุดเวเลนซ์อิเล็กตรอนซึ่งมีพลังงานมากกว่าตัวอื่น ๆ อยู่ ก่อนแล้ว ก็จะมีพลังงานมากจนเอาชนะแรงดึงดูดจากโปรตอนได้
มีผลให้หลุดออกจากอะตอมไปเป็นตัวแรก
พลังงานที่ใช้เรียกว่า IE1 ถ้าเปรียบเทียบกับ IE ที่เหลืออีก
12 ค่า IE1 จะมีค่าต่ำที่สุด ในขณะที่ IE ลำดับต่อ ๆ ไปจะมีค่าสูงขึ้น และ IE13
ซึ่งหมายถึงพลังงานที่ทำให้อิเล็กตรอนตัวสุดท้ายหลุดออกไปจากอะตอมของ Al จะมีค่าสูงสุดในบรรดา IE ทั้งหมดของ
Al เนื่องจาก อิเล็กตรอนตัวสุดท้ายเป็นอิเล็กตรอนตัวที่มีพลังงานที่ต่ำที่สุด
(อยู่ใกล้นิวเคลียสที่สุด)
จึงต้องใช้พลังงานมากมากที่สุด จึงจะช่วยให้หลุดออกจากอะตอมไปได้ ธาตุอื่น ๆ
ก็มีรูปแบบทำนองเดียวกัน นี้ ค่า IE ทั้ง
13 ค่าของ Al เมื่อนำมาเรียงลำดับจะเป็นดังตาราง ต่อไปนี้
|
ธาตุ
|
พลังงานไอโอไนเซชัน (MJ
mol - )
|
|
IE1
|
IE2
|
IE3
|
IE4
|
IE5
|
IE6
|
IE7
|
IE8
|
IE9
|
IE10
|
IE11
|
IE12
|
IE13
|
|
Al
|
0.58
|
1.82
|
2.75
|
11.58
|
14.83
|
18.38
|
23.30
|
27.46
|
31.90
|
38.46
|
42.66
|
201.08
|
222.32
|
สังเกตให้ดีจะเห็นว่าการเพิ่มขึ้นของค่า
IE1 ถึง IE13 จะมีบางช่วงมีค่าห่างกันมากอย่างผิดสังเกต ได้แก่ระหว่าง IE3 กับ
IE4
และระหว่าง IE11 กับ IE12 ข้อมูลนี้ให้จินตนาการว่า อิเล็กตรอนชุดใดมีค่า IE
ใกล้เคียงกันแสดงว่าเป็นอิเล็กตรอนกลุ่มเดียวกัน โคจรอยู่รอบนิวเคลียสในระดับพลังงาน (shell , energy level) เดียวกัน หรืออยู่ห่างจากนิวเคลียสเท่า ๆ กัน ช่วงที่มีค่า IE ต่างกันมากอย่างผิดสังเกตจะเป็นช่องว่างระหว่างระดับพลังงานของอิเล็กตรอนแต่ละกลุ่ม จากกรณีของ Al สามารถแบ่งกลุ่มอิเล็กตรอนทั้ง 13
ตัว ตามระดับพลังงานออกเป็น 3
กลุ่ม คือ
กลุ่มที่ 1
มีอิเล็กตรอน 3 ตัว
ดูจากค่า IE1 ถึง IE3 มีค่าใกล้เคียงกัน อิเล็กตรอนกลุ่มนี้ เป็นอิเล็กตรอนชั้นนอกสุดของ Al (n=3) เรียกว่าเวเลนซ์อิเล็กตรอน (Valence electron)
เป็น อิเล็กตรอนกลุ่มที่มีพลังงานมากที่สุด
กลุ่มที่ 2
มีอิเล็กตรอน 8 ตัว
ดูจากค่า IE4 ถึง IE11 มีค่าใกล้เคียงกัน
อิเล็กตรอนกลุ่มนี้อยู่ถัดจากอิเล็กตรอนกลุ่มแรกเข้ามา (n=2)
กลุ่มที่ 3
มีอิเล็กตรอน 2 ตัว
ดูจากค่า IE12 ถึง IE13 มีค่าใกล้เคียงกัน อิเล็กตรอนกลุ่มนี้อยู่ใกล้นิวเคลียสมากที่สุด
(n=1) เป็นอิเล็กตรอนที่มีพลังงานน้อยที่สุด
สำหรับโปรตอนกับนิวตรอนจะรวมกันเป็นนิวเคลียสของอะตอม
อะตอมของ Al เมื่อเขียนแสดงด้วยแบบจำลองอะตอมของโบห์ร
จะเป็นดังนี้

พิจารณาค่า IE ของธาตุอื่น ๆ
ดังตาราง
|
ธาตุ
|
พลังงานไอโอไนเซชัน (MJ mol - )
|
|
IE1
|
IE2
|
IE3
|
IE4
|
IE5
|
IE6
|
IE7
|
IE8
|
IE9
|
IE10
|
IE11
|
IE12
|
IE13
|
|
1 H
|
1.31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 He
|
2.37
|
5.25
|
|
|
|
|
|
|
|
|
|
|
|
|
3 Li
|
0.52
|
7.30
|
11.82
|
|
|
|
|
|
|
|
|
|
|
|
4 Be
|
0.90
|
1.76
|
14.85
|
21.01
|
|
|
|
|
|
|
|
|
|
|
5 B
|
0.80
|
2.43
|
3.66
|
25.03
|
32.83
|
|
|
|
|
|
|
|
|
|
6 C
|
1.09
|
2.35
|
4.62
|
6.22
|
37.83
|
47.28
|
|
|
|
|
|
|
|
|
7 N
|
1.40
|
2.86
|
4.58
|
7.48
|
9.45
|
53.27
|
64.36
|
|
|
|
|
|
|
|
8 O
|
1.32
|
3.39
|
5.30
|
7.47
|
10.99
|
13.33
|
71.14
|
84.08
|
|
|
|
|
|
|
9 F
|
1.68
|
3.38
|
6.05
|
8.41
|
11.02
|
15.17
|
17.87
|
92.04
|
106.44
|
|
|
|
|
|
10 Ne
|
2.08
|
3.95
|
6.12
|
9.37
|
12.18
|
15.24
|
20.00
|
23.07
|
115.38
|
131.44
|
|
|
|
|
11 Na
|
0.52
|
4.56
|
6.91
|
9.55
|
13.35
|
16.61
|
20.12
|
25.49
|
28.94
|
141.37
|
159.08
|
|
|
|
12 Mg
|
0.74
|
1.45
|
7.73
|
10.54
|
13.63
|
18.00
|
21.71
|
25.66
|
31.65
|
35.56
|
170.00
|
189.37
|
|
|
13 Al
|
0.58
|
1.82
|
2.75
|
11.58
|
14.83
|
18.38
|
23.30
|
27.46
|
31.90
|
38.46
|
42.66
|
201.08
|
222.32
|
ให้สังเกตว่าค่า IE จำนวน 2
ค่าสุดท้ายของแต่ละธาตุจะมีค่ามากที่สุด
แสดงว่าธาตุต่าง ๆ มีอิเล็กตรอนกลุ่มที่อยู่ใกล้นิวเคลียสมากที่สุดจำนวน 2
ตัว กลุ่มที่อยู่ถัดออกมาจะมีไม่เกิน 8
ตัว
เมื่อศึกษาข้อมูลทำนองนี้กับธาตุทั้งหมด
ทำให้ทราบในเบื้องต้นว่า บรรดาธาตุที่มีอยู่ในขณะนี้อะตอมจะมีระดับพลังงาน
ของอิเล็กตรอน (shell , energy level) ได้ 7 ระดับ คือระดับพลังงาน n = 1 , n = 2, n = 3 , n = 4 , n = 5
, n = 6 , n=7 หรือ ระดับพลังงาน K, L, M, N, O, P, Q และต่อมาจึงพบว่ามีระดับพลังงานย่อย (subshell) คือ s, p, d, f
อยู่ในระดับพลังงานต่าง ๆ
ด้วย
ดังรูป
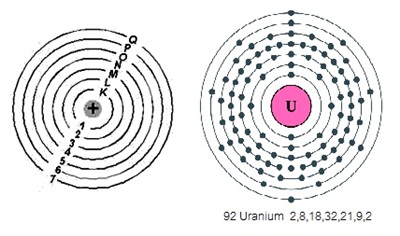
( คลิ้ก ชมระดับพลังงาน ,shell ,energy level ของอะตอม)
ระดับพลังงานย่อย (subshell ,
subenergy level)
พบว่าอิเล็กตรอนแต่ละตัวที่อยู่ในระดับพลังงาน ( Shell )
เดียวกัน จะมีพลังงานไม่เท่ากัน จึงมีการจัดเป็นกลุ่มย่อยเรียกว่าระดับพลังงานย่อย
( subshell) มีชื่อว่า s
p d f (g h
i แต่ขณะ นี้ยังไม่พบ)
โดยแต่ละ subshell จะมีอิเล็กตรอนได้สูงสุดไม่เท่ากัน ดังนี้
จำนวนอิเล็กตรอนของแต่ละระดับพลังงานย่อย (subshell ,
sublevel)
|
ชื่อระดับพลังงานย่อย
|
จำนวนอิเล็กตรอนที่มีได้สูงสุด
|
|
s
|
2
|
|
p
|
6
|
|
d
|
10
|
|
f
|
14
|
|
g (ขณะนี้ยังไม่พบ)
|
18
|
|
h (ขณะนี้ยังไม่พบ)
|
22
|
|
i (ขณะนี้ยังไม่พบ)
|
26
|
** สังเกต
จำนวนอิเล็กตรอนของระดับพลังงานย่อยจะเพิ่มขึ้นระดับละ 4 ตัว
แต่ละ shell จะประกอบด้วย subshell ต่าง ๆ
ที่พบแล้วมีดังนี้ (ตั้งแต่
n = 5 มี subshell อื่นที่ได้จากการคำนวณ แต่ยังไม่พบว่ามีอยู่จริง , แสดงอยูในวงเล็บ)
ระดับพลังงาน
n = 1 หรือ K มีระดับพลังงานย่อย 1 ระดับคือ s เรียกว่า 1s
ระดับพลังงาน n = 2 หรือ L มีระดับพลังงานย่อย 2 ระดับคือ s,p เรียกว่า 2s 2p
ระดับพลังงาน n = 3 หรือ M มีระดับพลังงานย่อย 3 ระดับคือ s,p,d เรียกว่า 3s
3p 3d
ระดับพลังงาน n = 4 หรือ N มีระดับพลังงานย่อย 4 ระดับคือ s,p,d,f เรียกว่า
4s 4p 4d 4f
ระดับพลังงาน n = 5 หรือ O มีระดับพลังงานย่อย 4 ระดับคือ s,p,d,f เรียกว่า 5s
5p 5d 5f (5g)
ระดับพลังงาน n = 6 หรือ P มีระดับพลังงานย่อย 3 ระดับคือ s,p,d เรียกว่า 6s
6p 6d (6f
6g 6h)
ระดับพลังงาน n = 7 หรือ L มีระดับพลังงานย่อย 2 ระดับคือ s,p เรียกว่า 7s
7p (7d 7f 7g 7h 7i)
*
จำนวนอิเล็กตรอนที่แต่ละ shell , energy level จะมีได้สูงสุดจากการคำนวณ =
2n2 ตัว
* ในวงเล็บเป็น subshell , subenergy level ที่ได้จากการคำนวณ ธาตุที่มีอยู่ในปัจจุบันยังไม่มี subshell
,
subenergy level เหล่านี้ subshell 5g มีอิเล็กตรอนได้ 18 ตัว ธาตุที่จะมี subshell นี้จะต้องมีเลขเชิงอะตอมตั้งแต่ 121 ขึ้นไป
(คลิ้ก อ่านเพิ่มเติม)
แผนผังแสดงระดับพลังงาน
(shell) และระดับพลังงานย่อย (subshell) ตามที่มีจริง

ระดับพลังงาน n = 1 เป็นระดับที่มีพลังงานต่ำที่สุดและอยู่ใกล้นิวเคลียสมากที่สุด ระดับพลังงาน
n = 2 , n = 3 , n = 4 , n = 5 , n = 6 , n
= 7 จะอยู่ห่างจากนิวเคลียสออกไปตามลำดับและมีพลังงานสูงขึ้นตามลำดับด้วย แต่พบว่าอิเล็กตรอนที่อยู่ในระดับพลังงานย่อย (subshell
,sublevel) บาง ระดับ จะมีพลังงานเหลื่อมล้ำกัน
คือบางระดับพลังงานย่อย (subshell)
ของระดับพลังงาน (energy level , shell) ที่สูงกว่า แต่มีพลังงานต่ำกว่าบางระดับพลังงานย่อย
(sublevel , subshell) ของระดับ พลังงาน (energy level,shell)
ที่ต่ำกว่า เช่น 4s มีพลังงานต่ำกว่า 3d ความเหลื่อมดังกล่าวแสดงได้ดังแผนภาพต่อไปนี้
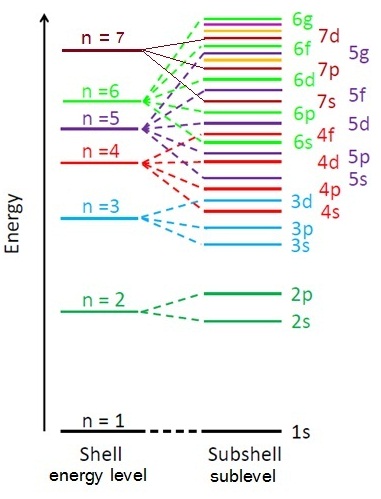
การเรียงลำดับของ subshell
ตามระดับพลังงานในแผนผังด้านบนนี้
รวม subshell ที่ยังไม่พบอยู่ด้วย แต่ถ้าตัด subshell ที่ยังไม่พบออกไป จะเป็นดังนี้
เมื่อเรียงลำดับของระดับพลังงานย่อย
(subshell) จากพลังงานต่ำสุดไปถึงพลังงานสูงสุดจะเป็นดังนี้

เมื่อเรียงลำดับของ subshell จากพลังงานต่ำไปสูง จะเป็นดังนี้
|
พลังงานต่ำ → พลังงานสูง
|
|
1s
|
2s
|
2p
|
3s
|
3p
|
4s
|
3d
|
4p
|
5s
|
4d
|
5p
|
6s
|
4f
|
5d
|
6p
|
7s
|
5f
|
6d
|
7p
|
(คลิ้ก
อ่านเพิ่มเติม)
ออร์บิทัล (orbital)
ในการจัดอิเล็กตรอนนั้นพบว่าในที่สุดแล้วอิเล็กตรอนจะอยู่กันเป็นคู่
ๆ ณ บริเวณใดบริเวณหนึ่งรอบ ๆ นิวเคลียสทั้ง
3 มิติ เรียกพื้นที่ซึ่งอิเล็กตรอนแต่ละคู่อยู่ร่วมกันว่า
ออร์บิทัล (orbital)
แต่ละ subshell จะมีจำนวนออร์บิทัลได้สูงสุดดังนี้

*
การเขียนแสดงออร์บิทัล มีหลายแบบ
(คลิ้ก
ชมได้)
หลักการจัดอิเล็กตรอนอะตอม
นักวิทยาศาสตร์ 3 คน
เป็นผู้ค้นพบหลักการจัดอิเล็กตรอนของอะตอม
หลักการดังกล่าวมีดังนี้
1. หลักของอาฟบาว
( Aufbau's Principle , 1934 พ.ศ. 2477 ) กล่าวว่า
“การบรรจุอิเล็กตรอนของอะตอมในภาวะปกติ ต้องบรรจุลงในออร์บิทัลที่มีพลังงานต่ำสุดและว่างก่อนเสมอ” (The Aufbau Principle states that in the ground state of an atom, an electron enters the orbital
with lowest energy first and subsequent electrons are fed in the order of increasing
energies.) ให้ถือว่าอิเล็กตรอนในทุกออร์บิทัลของ subshell เดียวกัน มีพลังงานเท่ากัน เช่น subshell 2p มี 3 ออร์บิทัล
คือ px py pz ดังรูป
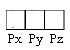
บรรจุอิเล็กตรอนได้ออร์บิทัลละ 2
ตัว จึงบรรจุอิเล็กตรอนได้ทั้งหมดไม่เกิน 6
ตัว ให้ถือว่าอิเล็กตรอนทั้ง 6 ตัว มีพลังงานเท่ากัน
(คลิ้ก ชมลักษณะการจัดอิเล็กตรอนลงในออริบิทัลตามกฏของอาฟบาว)
2. หลักการกีดกันของเพาลี (Pauli's
Exclusion Principle ค.ศ.1925 พ.ศ. 2468 ) กล่าวว่า
แต่ละออร์บิทัลจะมีอิเล็กตรอนได้มากที่สุดเพียง
2 ตัว ( 1 คู่)
โดยอิเล็กตรอนดังกล่าว จะมีเลขค วอนตัมเหมือนกัน 3 ค่า คือเลขควอนตัมหลัก (Principle quantum
number)
เลขควอนตัมออร์บิทัล (orbital quantum number) และเลขควอนตัมแม่เหล็ก
(magnetic quantum number) ต่างกัน
1 ค่า คือเลขควอนตัมสปิน (spin quantum
number) คือการหมุนรอบตัวเองไม่เหมือนกัน ตัวหนึ่งหมุนตามเข็มนาฬิกา ขณะที่อีกตัวหนึ่งหมุนทวนเข็มนาฬิกา ให้ใช้  แทนออร์บิทัล
ใช้ลูก ศรแทนอิเล็กตรอนในออร์บิทัล
ถ้ามีอิเล็กตรอน 1 ตัว
เขียนแสดงดังนี้ แทนออร์บิทัล
ใช้ลูก ศรแทนอิเล็กตรอนในออร์บิทัล
ถ้ามีอิเล็กตรอน 1 ตัว
เขียนแสดงดังนี้  หรือ หรือ  หัวลูกศรแสดงทิศทางการหมุนของอิเล็กตรอน
ลูกศรชี้ขึ้นคือการหมุนตามเข็มนาฬิกา
ลูกศรชี้ลงคือการ หมุนทวนเข็ม นาฬิกา
ถ้าที่มีอิเล็กตรอนเต็มออร์บิทัลคือมี
2 ตัว เขียนแสดงดังนี้ หัวลูกศรแสดงทิศทางการหมุนของอิเล็กตรอน
ลูกศรชี้ขึ้นคือการหมุนตามเข็มนาฬิกา
ลูกศรชี้ลงคือการ หมุนทวนเข็ม นาฬิกา
ถ้าที่มีอิเล็กตรอนเต็มออร์บิทัลคือมี
2 ตัว เขียนแสดงดังนี้  หรือ หรือ  ถ้าเขียนดังนี้ ถ้าเขียนดังนี้  หรือดังนี้ หรือดังนี้  จะไม่สอดคล้องกับหลักการกีดกันของเพาลี (เรื่องเลข ควอนตัมอยู่ตอนท้ายของบทนี้) จะไม่สอดคล้องกับหลักการกีดกันของเพาลี (เรื่องเลข ควอนตัมอยู่ตอนท้ายของบทนี้)
* The Pauli Exclusion
Principle states that no two electrons can have the same four quantum
numbers. The first three may be similar but the four quantum number must be different.
We are aware that in one orbital a maximum of two electrons can be found and
the two electrons must have opposing spins. That means one would spin up (
+1/2) and the other would spin down (-1/2)
ตัวอย่าง ธาตุฮีเลียมมีอิเล็กตรอน 2
ตัว บรรจุในออร์บิทัล 1s
; He อิเล็กตรอนแต่ละตัวจะมีเลขควอนตัมทั้ง 4
ค่า ดังนี้
|
อิเล็กตรอนของฮีเลียม
|
เลขควอนตัม
|
|
n
|
l
|
ml
|
ms
|
|
ตัวที่ 1(สปินขึ้น หรือหมุนตามเข็มนาฬิกา)
|
1
|
0
|
0
|
+1/2
|
|
ตัวที่ 2(สปินลงหรือหมุนทวนเข็มนาฬิกา)
|
1
|
0
|
0
|
-1/2
|
3. หลักของฮุนด์ (Hund's rule, 1927 พ.ศ. 2470) การบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ จะบรรจุอิเล็กตรอนเดี่ยว ๆ ก่อน จากนั้นจึงบรรจุเป็นคู่ ขณะที่บรรจุอิเล็กตรอนเดี่ยว อิเล็กตรอน แต่ละตัวจะมีทิศทางในการหมุนทางเดียวกัน
( Hund's
rule: every orbital in a subshell is singly occupied with one
electron before any one orbital is doubly occupied, and all electrons in singly
occupied orbitals have the same spin. ) อาจเรียกการบรรจุอิเล็กตรอนแบบเดี่ยวว่า
การบรรจุครึ่ง (half filled) เรียกการบรรจุอิเล็กตรอนเป็นคู่ว่าบรรจุเต็ม
(full filled) อิเล็กตรอนในออร์บิทัลเดียวกันมีพลังงานเท่ากัน ดังตัวอย่าง

พิจารณาอะตอมของไฮโดรเจนซึ่งมีอิเล็กตรอน
1
ตัว เมื่ออะตอมอยู่ในภาวะพื้น (ground
state)อิเล็กตรอนจะอยู่ใน 1s–orbital
เป็นการบรรจุครึ่ง ดังแผนภาพ

พิจารณาอะตอมของฮีเลียมซึ่งมีอิเล็กตรอน 2 ตัว เมื่ออะตอมอยู่ในภาวะพื้น (ground
state)อิเล็กตรอนทั้ง
2 ตัวจะอยู่ใน 1s–orbital เป็นการบรรจุเต็ม ดังแผนภาพ
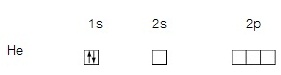
ตัวอย่าง ถ้ามีอิเล็กตรอน 1 ตัว ใน 2p orbital จะบรรจุอิเล็กตรอนดังนี้
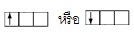
* ถ้าบรรจุในลักษณะอื่นจะผิด
เช่น
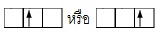 (ผิดหลักของอาฟบาว
เพราะไม่บรรจุอิเล็กตรอนในออร์บิทัลที่มีพลังงานต่ำและว่างเสียก่อน) (ผิดหลักของอาฟบาว
เพราะไม่บรรจุอิเล็กตรอนในออร์บิทัลที่มีพลังงานต่ำและว่างเสียก่อน)
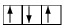
ถ้ามีอิเล็ตรอน 2 ตัว ใน 2p–orbital จะบรรจุอิเล็กตรอนดังนี้

* ถ้าบรรจุในลักษณะอื่นจะผิด เช่น

( ผิดหลักของอาฟบาว
เพราะไม่บรรจุอิเล็กตรอนในออร์บิทัลที่มีพลังงานต่ำและว่างเสียก่อน )
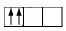
( ผิดหลักของเพาลี เพราะอิเล็กตรอนในออร์บิทัลเดียวกัน ต้องมีทิศทางในการหมุนตรงกันข้าม )

( ผิดหลักของฮุนด์ เพราะต้องบรรจุแบบเดี่ยวให้เต็มทุกออร์บิทัลเสียก่อน แล้วค่อยบรรจุเป็นคู่ )
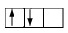
( ผิดหลักของฮุนด์
เพราะขณะบรรจุแบบเดี่ยวอิเล็กตรอนแต่ละตัวจะมีทิศทางในการหมุนทางเดียวกัน)
ถ้ามีอิเล็ตรอน 3 ตัว ใน 2p–orbital จะบรรจุอิเล็กตรอนดังนี้
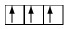
* ถ้าบรรจุในลักษณะอื่นจะผิด เช่น

จงพิจารณาว่าผิดอย่างไร ..........................................................
จงพิจารณาว่าผิดอย่างไร..........................................................
(คลิ้ก อ่านเพิ่มเติม )
(คลิ้ก
ชมการจัดเต็ม-จัดครึ่ง)
(คลิ้ก ชมการจัดอิเล็กตรอนใน
ออร์บิทัล s ) (คลิ้ก ชมการจัดอิเล็กตรอนในออร์บิทัล p)
(คลิ้ก ชมการจัดอิเล็กตรอนในทุก
ๆ ออร์บิทัล )
การจัดอิเล็กตรอนของธาตุที่มีเลขเชิงอะตอมตั้งแต่ 1
ถึง 20 เป็นดังนี้

** อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอม เรียกว่า เวเลนซ์อิเล็กตรอน (valence
electron) เป็นอิเล็กตรอนที่มีความสำคัญมาก เพราะจะเป็นตัวแสดงสมบัติทางเคมี ของอะตอมนั้น
ๆ พบว่าธาตุต่างชนิดที่มีเวเลนซ์อิเล็กตรอนเท่ากัน จะมีสมบัติทางเคมีคล้ายกัน เช่น Li
Na K
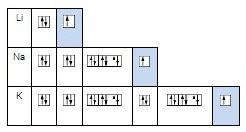
จะเห็นได้ว่าทั้ง 3
ธาตุมีเวเลนซ์อิเล็กตรอนเท่ากับ
1 ฉะนั้นธาตุทั้ง 3
ชนิดนี้มีสมบัติทางเคมีคล้ายกัน
ได้แก่เป็นโลหะ
ทำปฏิกิริยากับน้ำและออกซิเจนได้เหมือนกันแต่ความรุนแรงไม่เท่ากัน ถ้าดูจากตารางธาตุจะเห็นว่าจัดเอาไว้ในหมู่เดียวกันคือหมู่
1A (คลิ้ก ดูตารางธาตุ)
แต่อย่างไรก็ตามพบว่าธาตุบางธาตุที่มีการบรรจุอิเล็กตรอนในบาง
subshell ไม่เป็นไปตามหลักการของนักวิทยาศาสตร์ทั้ง 3
คน อย่างสมบูรณ์ แบบ เช่น 24Cr ( มีเลขเชิงอะตอม
24 ) 29Cu (มีเลขเชิงอะตอม 29) การจัดอิเล็กตรอนใน subshell
4s ไม่เป็นไปตามกฎของอาฟบาว คือใน subshell ที่มีพลังงานต่ำกว่ายังไม่เต็มแต่มีการบรรจุอิเล็กตรอนใน
subshell 3d ที่พลังงานสูงกว่า ดัง รูป

แต่อย่างไรก็ตามพบว่าธาตุบางธาตุที่มีการบรรจุอิเล็กตรอนในบาง subshell ไม่เป็นไปตามหลักการของนักวิทยาศาสตร์ทั้ง 3
คน อย่างสมบูรณ์ แบบ เช่น 24Cr ( มีเลขเชิงอะตอม
24 ) 29Cu (มีเลขเชิงอะตอม 29) การจัดอิเล็กตรอนใน subshell
4s ไม่เป็นไปตามกฎของอาฟบาว คือใน subshell ที่มีพลังงานต่ำกว่ายังไม่เต็มแต่มีการบรรจุอิเล็กตรอนใน
subshell 3d ที่พลังงานสูงกว่า ดัง รูป

- กรณีนี้ไม่เป็นไปตามกฎของอาฟบาวเช่นกัน เพราะอิเล็กตรอนที่ระดับพลังงาน 4s ซึ่งมีพลังงานต่ำกว่ายังไม่เต็ม แต่จัดอิเล็กตรอนที่เหลือลงใน 3d ซึ่งมีพลังงานสูงกว่า แต่เป็นไปตามกฎของเพาลี (กฎของเพาลีกล่าวว่าในแต่ละออร์บิทัลมีอิเล็กตรอนไม่เกิน
2 ตัว) และกฎของฮุน (กฎของฮุนกล่าวว่าการจัดอิเล็กตรอนแบบจัดเต็มหรือจัดครึ่งเป็นแบบที่ทำให้อะตอมเสถียรที่สุด)
จะเห็นว่าเป็นการจัดครึ่งใน
4s และจัดเต็มใน 3d
การเขียนแสดงการจัดอิเล็กตรอนของธาตุ
ในการเขียนแสดงการจัดอิเล็กตรอนของธาตุต่าง
ๆ เขียนได้หลายแบบ เช่น
การจัดอิเล็กตรอนของ24Cr สามารถเขียนแสดงได้ดังนี้ ดังนี้
แบบที่ 1 24Cr
; 1s2
2s2 2p6 3s2 3p6 4s1 3d5
เป็นการเรียงลำดับจากพลังงานต่ำไปสูงของ
subshell ตามการเหลื่อมของพลังงาน ( 4s พลังงานต่ำกว่า 3d จึงเขียน 4s ก่อน
3d )
แบบที่ 2 24Cr ; 1s2 2s2 2p6 3s2 3p6 3d5 4s1
เป็นการเรียงลำดับตาม
subshell จากต่ำไปสูง
โดยไม่เป็นไปตามการเหลื่อมของพลังงาน สังเกตว่าเขียน subshell ทั้งหมดของ
shell หรือ energy level เดียวกันเอาไว้ด้วยกัน
แบบที่
3 24Cr
2 , 8 , 13 , 1
เป็นการเขียนโดยรวมอิเล็กตรอนของแต่ละ subshell
หรือ
subenergy level ของแต่ละ shell หรือ
energy level
เข้าด้วยกัน
แบบที่
4 เขียนแสดงด้วย orbitals เป็นการแสดงให้เห็นว่าอิเล็กตรอนแต่ละตัวถูกจัดไว้ที่ใด เป็นดังนี้

อาจสลับที่ระหว่าง 4s1 กับ
3d5
ก็ได้ ดังรูป

กรณีของ
29Cu
จะเป็นดังนี้
29Cu
; 1s2 2s2 2p6 3s2 3p6 4s1 3d10
หรือ 29Cu ; 1s2
2s2 2p6 3s2 3p6 3d10 4s1
หรือ 29Cu ; 2 , 8 , 18 , 1

อาจสลับที่ระหว่าง 4s1 กับ
3d10 ก็ได้
ดังรูป

การจัดอิเล็กตรอนในอะตอมของธาตุต่าง ๆ จะมีรูปแบบโดยรวมคล้ายกัน คือจัดให้อิเล็กตรอนที่มีพลังงานต่ำสุดบรรจุไว้ในออร์บิทัลที่มีพลังงานต่ำสุดก่อน
(หลักของอาฟบาว) คือที่ 1s จากนั้นถ้ายังมีอิเล็กตรอนเหลืออยู่ จึงบรรจุในออร์บิทัลของระดับพลังงานย่อย (subshell, sublevel) ที่มีพลังงานสูงขึ้นคือ 2s … ต่อไปจนหมด
แต่เนื่องจากมีความเหลื่อมล้ำของระดับพลังงานย่อยดังได้กล่าวมาแล้ว จึงมีการคิดแผนผังแสดงลำดับในการจัดอิเล็กตรอนตามระดับพลังงานของของ subshell
ในอะตอมต่าง ๆ จากพลังงานต่ำไปสูงทำให้เกิดความสะดวกและป้องกันความสับสน แผนผังดังกล่าวมีหลายแบบ เช่น
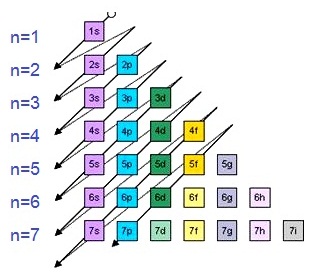

การบรรจุอิเล็กตรอนให้เริ่มต้นที่ 1s เรียงลำดับไปตามแนวลูกศรจนกว่าจะหมด
(คลิ้ก ชมการจัดอิเล็กตรอนของ 28Ni แสดงใน orbital)
ตัวอย่าง การจัดอิเล็กตรอนของ 11Na เป็นดังนี้
11Na มีอิเล็กตรอน 11 ตัว จัดอิเล็กตรอนใน subshells ตามลำดับดังนี้
 1. แสดงในรูป subshell หรือ subenergy level 11Na ; 1s2 2s2 2p6 3s1 1. แสดงในรูป subshell หรือ subenergy level 11Na ; 1s2 2s2 2p6 3s1
2. แสดงในรูป shell หรือ energy level 11Na 2 8 1 (มีเวเลนซ์อิเล็กตรอน = 1 )
3. แสดงในรูป orbitals ดังนี้

(อ่านต่อ ตอนที่ 10)
Content's Picture

Size : 53.28 KBs
Upload : 2015-04-08 07:29:02
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|