โครงสร้างอะตอม ตอนที่ 2 แบบจำลองอะตอมของดาลตันและทอมสัน
แบบจำลองอะตอมของดาลตัน (Ddlton atomic’s model 1808 , 2351) (คลิ้ก อ่านประวัติของจอห์น ดาลตัน)
ต้นคริสตวรรษที่ 18 คือ ปี ค.ศ.
1804 ( พ.ศ. 2347 ตรงกับสมัยรัชกาลที่ 1 ของไทย ครองราชย์ พ.ศ. 2325-2352
)
นักวิทยาศาสตร์อังกฤษ คือ
จอห์น ดาลตัน ( John Dalton ) เสนอ ทฤษฎีอะตอมของดาลตัน ดังนี้
- ธาตุแต่ละธาตุประกอบด้วยอนุภาคขนาดเล็กเรียกว่าอะตอม
(Each element is composed of extremely small particles called atom.)
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันทุกอะตอมแต่แตกต่างจากอะตอมของธาตุอื่น รวมทั้งมีมวลแตกต่างกันด้วย
(All atoms of the same element are identical to each other; the atoms of different elements are different and have different properties (including different masses)
- อะตอมของธาตุหนึ่งไม่สามารถเปลี่ยนเป็นอะตอมของธาตุอื่นได้เมื่อเกิดปฏิกิริยาเคมี และไม่สามารถสร้างอะตอมขึ้นใหม่หรือทำลายให้สูญหายไปได้จากปฏิกิริยาเคมี)
(Atom of an element are not change into different types of atom by chemical reaction; atoms are neither created nor destroyed in chemical reaction.)
- สารประกอบเกิดจากการรวมตัวของอะตอมของธาตุตั้งแต่สองชนิดขึ้นไป โดยมีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย เช่น 1:1
1:2 2:3 หรืออื่น ๆ
(Compounds are formed when atom of more than one element combine; a given compound always has the same relative number and kind of atoms, such as 1:1, 1:2, 2:3 and so on.)
ในทัศนของดาลตัน อะตอมมีลักษณะเป็นรูปทรงกลมโดยไม่ได้ระบุว่าภายในประกอบด้วยสิ่งใด และไม่ได้แสดงผลการทดลองทางวิทยาศาสตร์ว่าเหตุใดอะตอมจึงมีรูปทรงดังกล่าว แต่ข้อเสนอ ของดาลตันเสมือนเป็นจุดเริ่มต้นอย่างสำคัญที่กระตุ้นให้เกิดการค้นคว้าทางเคมีกันอย่างมากนับแต่นั้น ฉะนั้นต่อจากสมัยของดาลตัน จึงมีนักวิทยาศาสตร์ทำการทดลองเกี่ยวกับอะตอมกันอีกมากมาย ทำให้ทราบข้อมูลและสมบัติของอะตอมเพิ่มมากขึ้นอย่างต่อเนื่อง มีผลการค้นพบใหม่ ๆ
บางเรื่องไม่สอดคล้องกับแนวคิดของดาลตัน เช่น พบว่าอะตอมประกอบด้วยอนุภาคย่อย ๆ ที่มีขนาดเล็กลงไป อีก
และอะตอมของธาตุชนิดเดียวกันอาจไม่เหมือนกันทุกประการก็ได้ เช่น มีมวลต่างกัน (เป็นไอโซโทปกัน) ปฏิกิริยานิวเคลียร์อาจทำให้อะตอมของธาตุหนึ่งสูญหายไป
แต่มีอะตอมของอีกธาตุหนึ่ง เกิดขึ้นมาใหม่ได้
ทฤษฎีอะตอมของดาลตันบางข้อจึงไม่เป็นจริงทั้งหมด
นักวิทยาศาสตร์ในยุคต่อ ๆ มา ได้พยายามศึกษาเกี่ยวกับสมบัติของอะตอม เมื่อได้ผลทดลองที่มากพอและแปรความหมาย ได้ นักวิทยาศาสตร์ก็จะเสนอแบบจำลองอะตอมขึ้นมาใหม่

แบบจำลองอตอมของดาลตัน
แบบจำลองอะตอมของทอมสัน (Thomson
‘s atomic model 1904 , 2447) (คลิ้กอ่านประวัติของทอมสัน)
บุคคลสำคัญที่มีผลอย่างมากต่อการค้นพบของทอมสันคือ Sir William Crookes (คลิ้กอ่านประวัติ)
ที่ได้สร้างเครื่องมือที่ใช้ทดสอบการนำไฟฟ้าของแก๊สขึ้นเป็นผลสำเร็จ สิ่งนั้นคือ หลอดรังสีแคโทด (Cathode Ray Tube ; CRT) ซึ่งทำด้วยหลอดแก้ว มีแผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า (Electrode) อยู่ที่ปลายทั้ง 2 ด้าน
ภายในหลอดบรรจุแก๊สโดยทำให้มีความดันต่ำ (คือสูบแก๊สออกจนเกือบ เป็นสูญญากาศ)
การทำงานของหลอดรังสีแคโทด ต้องต่อขั้วไฟฟ้าทั้ง 2 ขั้วเข้ากับแหล่งจ่ายไฟฟ้ากระแสตรง
(D.C. ; Direct
Current) ความต่างศักย์สูงมาก การเรียกขั้วไฟฟ้าเป็นขั้วบวก ขั้วลบ
และการ เรียกเป็นแอโนด (anode) แคโทด (cathode) มักจะมีความสับสนอยู่เสมอ มีหลักการกำหนดว่า ขั้วที่ต่อกับขั้วบวกของแหล่งจ่ายไฟฟ้าจะเรียกว่าแอโนด (Anode) (ไม่พูดว่าแอโนดคือขั้วบวก แต่ให้ พูดว่าขั้วที่ต่อกับขั้วบวกของแหล่งจ่ายไฟเรียกว่าแอโนด)
ในขณะเดียวกันขั้วที่ต่อกับขั้วลบของแหล่งจ่ายไฟ จะเรียกว่าว่าแคโทด (Cathode) (ไม่พูดว่าขั้วลบคือแคโทด
แต่ให้พูดว่าขั้วที่ต่อกับ ขั้วลบของแหล่งจ่ายไฟเรียกว่าแคโทด)เมื่อต่อขั้วไฟฟ้าให้ครบวงจรแล้ว พบว่ามีกระแสไฟฟ้าไหลครบวงจร แต่มองไม่เห็นการเปลี่ยนแปลงใด ๆ ในหลอดรังสีแคโทด (รูปทรงของหลอดรังสีแคโทดมี หลายแบบ แต่มีหลักการทำนองเดียวกัน) ดังรูป

ค.ศ.1904 (พ.ศ. 2440 ตรงกับสมัยรัชการที่ 5 พ.ศ. 2411 - 2453) เซอร์โจเซฟ จอห์น ทอมสัน (J.J.
Thomson) ได้ทดลองเกี่ยวกับการนำไฟฟ้าของแก๊สโดยใช้หลอดรังสีแคโทด เพิ่ม เติมจากการทดลองของ Sir
William Crookes
ด้วยวิธีการ ขั้นตอน และลำดับการค้นพบสิ่งต่าง ๆ ดังนี้
1. เริ่มต้นการทดลอง
บรรจุแก๊สชนิดหนึ่งไว้ในหลอดรังสีแคโทดแล้วสูบแก๊สออกจนเกือบหมดเพื่อทำให้ภายในมีความดันต่ำ ต่อขั้วหลอดทั้งสองขั้วเข้ากับเครื่องกำเนิดไฟฟ้ากระแสตรงความ ต่างศักย์สูง
หลังแอโนด
(ขั้วที่ต่อกับขั้วบวกของแหล่งจ่ายไฟ) ซึ่งเจาะรูตรงกลาง มีฉากเรืองแสงซึ่งเคลือบด้วย ZnS ( ซิงค์ซัลไฟด์ ) วางอยู่ (ถ้าไม่มีแผ่นเรืองแสงจะไม่เห็นปรากฏการที่เกิดขึ้น) เมื่อปล่อยกระแสไฟฟ้าครบวงจรพบว่า มีจุดสว่างบนฉากเรืองแสงอยู่ในแนวตรงกับรูที่เจาะไว้ที่แอโนด เชื่อว่าเกิดจากรังสีที่พุ่งจากแคโทดไปที่แอโนด แล้วมีบางส่วนวิ่งผ่านรูที่เจาะเอาไว้ จึงเรียกสิ่งนี้ ว่ารังสีแคโทด (Cathode ray) ดังรูป

2. การค้นพบประจุไฟฟ้าของรังสีแคโทด เมื่อทอมสันได้เห็นปรากฏการณ์เช่นนั้นจึงทดลองเพิ่มเติมเพื่อพิสูจน์ว่า รังสีที่เกิดขึ้นมีประจุไฟฟ้าเป็นบวกหรือลบ ด้วยการดัดแปลงหลอดรังสี แคโทดเสีย ใหม่
โดยเพิ่มสนามไฟฟ้า ขนาบไว้กับแนวที่รังสีแคโทดพุ่งผ่าน พบว่ารังสีนี้เบนเข้าหาขั้วบวกของสนามไฟฟ้า (ถ้าใช้สนามแม่เหล็กจะเบนเข้าหาขั้วเหนือของสนามแม่เหล็ก (แบนหนี ขั้วใต้) แสดง ว่าขั้วบวกของสนามไฟฟ้า มีสมบัติเทียบได้กับขั้วเหนือของสนามแม่เหล็ก) ผลการทดลองนี้แสดงว่ารังสีแคโทดมีประจุลบ ดังรูป



3. การค้นพบอิเล็กตรอน ทอมสันได้ทดลองเพิ่มเติมโดยบรรจุแก๊สชนิดอื่นๆ
เข้าในหลอดรังสีแคโทดรวมทั้งเปลี่ยนชนิดของโลหะที่ใช้เป็นขั้วไฟฟ้า พบว่าจะได้รังสีแคโทดเหมือนเดิม จึง สรุปว่าสารทุกชนิดประกอบด้วยอนุภาคที่มีประจุลบเรียกว่าอิเล็กตรอน (electron
, e- ) ฉะนั้นจึงกล่าวได้ว่ารังสีแคโทดคือการเคลื่อนที่ของอิเล็กตรอนจำนวนมาก ทอมสันได้รับการยกย่องว่า เป็นผู้พบอิเล็กตรอน
และผลงานนี้ทำให้ทอมสันได้รับรางวัลโนเบลสาขาฟิสิกส์ในปี ค.ศ.1906 พ.ศ. 2449 (รางวัลโนเบลคืออะไร คลิ้กดูได้ที่นี่)
นอกจากนั้นยังมีการคันพบที่สำคัญอย่างยิ่งอีกประการ หนึ่งคือ เขาสามารถคำนวณหาอัตราส่วนระหว่างประจุต่อมวลของอิเล็กตรอน
( e/m) โดยที่ขณะนั้นยังไม่ทราบว่าอิเล็กตรอนมีประจุ (e) และมีมวล (m) เท่าไร ดังสมการ
e/m =
-1.76 x
108 คูลอมบ์ต่อกรัม หรือ (
c/g )
* คูลอมบ์ , coulomb เป็นหน่วยสากล , SI ของประจุไฟฟ้า
(คลิ้ก ชม หลอดรังสีแคโทดและการทดลองทอมสัน)
(คลิกชมวีดีทัศน์แสดงปรากฏการณ์ในหลอดรังสีแคโทด)
(คลิ้ก ชมปรากฏการณ์ในหลอดรังสีแคโทดและการหาค่า e/m)
4. การหาค่าประจุไฟฟ้าของอิเล็กตรอนและการคำนวณหามวลของอิเล็กตรอน
ค.ศ. 1908 (พ.ศ. 2451 ตรงกับสมัยรัชกาลที่ 5 พ.ศ. 2411-2453) A. Millikan (คลิ้ก อ่านประวัติ) สามารถหาค่าประจุของอิเล็กตรอนโดยทดลองด้วยละอองน้ำมัน (oil
drop experiment) คือทดลองพ่นน้ำมันออกเป็นละอองเล็ก
ๆ แล้วทำให้มีประจุไฟฟ้าโดยใช้รังสีเอกซ์ (X-Ray) จากนั้นปล่อยให้ตกลงมาระหว่างแผ่นโลหะ
2 แผ่น ซึ่งมีประจุไฟฟ้าเช่นกัน การมี ประจุไฟฟ้าของละอองน้ำมันและประจุไฟฟ้าของแผ่นโลหะที่ละอองน้ำมันจะเคลื่อนที่ผ่าน มีผลให้เกิดแรงดึงดูดหรือผลักกันได้
คือถ้าประจุไฟฟ้าเหมือนกันจะผลักกัน ถ้าประจุตรงข้ามกันก็จะดูดกัน ถ้าไม่มีประจุไฟฟ้าก็จะไม่ดูด-ไม่ผลักซึ่งกันและกัน ละอองน้ำมันย่อมจะตกลงสู่พื้นด้วยแรงโน้มถ่วงของโลก ดังรูป
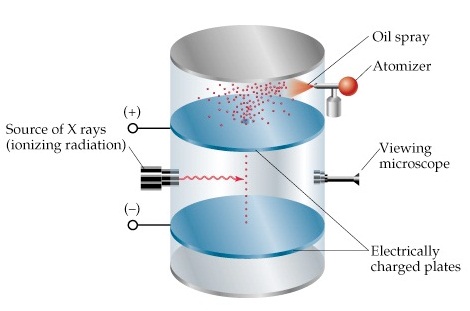
แต่เมื่อทำให้แผ่นโลหะมีประจุไฟฟ้า (แผ่นบนมีประจุบวก
แผ่นล่างมีประจุลบ) ละอองน้ำมันที่มีประจุลบจะดึงดูดกับโลหะแผ่นบน ทำให้ตกลงสู่พื้นช้าลง หรือหยุดนิ่ง
หรือลอยตัวขึ้นไปติดอยู่ กับแผ่นโลหะดังกล่าว
ขึ้นอยู่กับความแรงของประจุไฟฟ้า ถ้าละอองน้ำมันหยุดนิ่งแสดงว่าแรงจากสนามไฟฟ้ากับแรงโน้มถ่วงของโลกสมดุลกัน เมื่อทราบความแรงของสนามไฟฟ้าที่แผ่นโลหะแผ่น บนซึ่งมีประจุบวกดังกล่าว จะทำให้ทราบค่าของประจุไฟฟ้าที่มีอยู่บนละอองน้ำมันได้ ซึ่งพบว่าค่าประจุไฟฟ้าบนละอองน้ำมันมีหลายค่า แต่ค่าที่ต่ำสุดคือ -1.6 x
10-19
คูลอมบ์ นอกนั้นมีค่าเพิ่ม ขึ้นเป็นจำนวน
2 เท่าหรือหลาย ๆ เท่า ของ -1.6 x
10-19 คูลอมบ์ เช่น เพิ่มขึ้นเป็น
2 เท่า = 2(-1.6 x 10-19) = -3.2 x 10-19 คูลอมบ์ ถ้าเพิ่มขึ้นเป็น 3 เท่า
= 3(-1.6 x 10-19) = -4.8 x 10-19 คู ลอมบ์
มิลลิแกนสรุปว่าค่าประจุไฟฟ้าต่ำสุดที่เกิดขึ้นบนละอองน้ำมันคือประจุไฟฟ้าของอิเล็กตรอน เกิดจากละอองน้ำมันดังกล่าวมีอิเล็กตรอนไปเกาะอยู่ 1
ตัว
ถ้าละอองน้ำมันใดมีอิเล็กตรอนไปเกาะ อยู่
2 3 4 ...
ตัว
ประจุไฟฟ้าที่เกิดขึ้นบนละอองน้ำมันนั้นก็จะเพิ่มเป็น 2
3 4 ... เท่าของ -1.6 x
10-19 คูลอมบ์ ฉะนั้นประจุไฟฟ้าของอิเล็กตรอนจึงมีค่าเท่ากับ - 1.6 x 10-19 คูลอมบ์
เมื่อทราบประจุของอิเล็กตรอนแล้ว จึงแทนค่าประจุไฟฟ้าของอิเล็กตรอน (e) ไปลงในสมการของทอมสัน จะคำนวณหามวล
(m) ของอิเล็กตรอนได้
6. การค้นพบโปรตอน
ในช่วงเวลาเดียวกัน (ค.ศ.1900 ,พ.ศ.2443) ออยเกน โกลด์ชไตน์ (คลิ้ก อ่านประวัติ E.Goldstein) เป็นนักวิทยาศาสตร์อีกคนหนึ่งที่สนใจศึกษาเรื่องอะตอม
เชื่อว่าภายในอะตอมจะต้อง มีอนุภาคที่มีประจุบวกอยู่ด้วย
จึงหักล้างกับประจุลบของอิเล็กตรอนจนหมดไป ทำให้อะตอมในภาวะปกติจะเป็นกลางทางไฟฟ้า จึงพิสูจน์ด้วยการทดลองดังนี้
6.1 ดัดแปลงหลอดรังสีแคโทดด้วยการเจาะรูที่แผ่นแคโทด
(ทอมสันเจาะรูที่แอโนด) และใส่ฉากเรืองแสงเอาไว้ด้านหลังแคโทด (ทอมสันใส่แผ่นเรืองแสงไว้ด้านหลังแอโนด)
เมื่อปล่อย กระแสไฟฟ้าจึงพบว่ามีการเรืองแสงเกิดขึ้นที่ฉากเรืองแสง ขณะนั้นเข้าใจว่ามีรังสีพุ่งจากแอโนดมายังแคโทด
แล้วมีบางส่วนพุ่งทะลุผ่านรูที่เจาะเอาไว้ไปกระทบฉากเรืองแสงจึงมีการเรืองแสงเกิดขึ้น เมื่อทดสอบโดยใช้สนามไฟฟ้า และสนามแม่เหล็กเช่นเดียวกับการทดลองของทอมสัน พบว่ารังสีนี้เบนเข้าหาขั้วลบของสนามไฟฟ้าและเบนเข้าหาขั้วใต้ของสนามแม่เหล็ก
แสดงว่ารังสีนี้มีประจุไฟฟ้า เป็นบวก ขณะนั้นเรียก
รังสีนี้ว่ารังสีแอโนด หรือรังสีคาแนล (Canal ray) ต่อมาเปลี่ยนชื่อเป็นรังสีบวก (positive
ray) ดังรูป

6.2
ทดลองเพิ่มเติมกับแก๊สหลายชนิด พบว่า มีรังสีที่บวกเกิดขึ้นเช่นเดียวกัน แต่มีอัตราส่วนระหว่างประจุต่อมวล (e/m) ไม่คงที่ ขึ้นอยู่กับชนิดของแก๊สที่บรรจุภายในหลอด
ต่าง จาก กรณีของรังสีแคโทดซึ่งมี e/m คงที่ แสดงว่ารังสีบวกที่เกิดขึ้นนี้สัมพันธ์กับชนิดของแก๊สที่บรรจุในหลอด
แต่การค้นพบที่สำคัญคือเมื่อใช้แก๊สโฮโดรเจน จะพบว่ารังสีดังกล่าวมีประจุเท่ากับประจุ ของ อิเล็กตรอน แต่เป็นประจุตรงกันข้าม คือ +1.602
x 10-19 คูลอมบ์ ตั้งชื่ออนุภาคนี้ว่า โปรตอน (Proton , p) โกลด์ชไตน์จึงได้ขื่อว่าเป็นผู้พบโปรตอน
จำนวนโปรตอนเป็นค่าเฉพาะของธาตุ แต่ละ ชนิด
อะตอมของธาตุเดียวกันจะมีจำนวนโปรตอนเท่ากันทุกอะตอม
ฉะนั้นเมื่อต้องการจะทราบว่าเป็นอะตอมของธาตุใด ต้องดูที่จำนวนโปรตอนของธาตุนั้น ๆ จำนวนโปรตอนของแต่ละธาตุเรียก ว่าเลข เชิงอะตอม
(atomic number) ของธาตุนั้น
ๆ รายละเอียดของเรื่องนี้จะกล่าวถึงอีกครั้งหนึ่งหนึ่งในตอนหลัง (แหล่งอ้างอิงบางแห่งกล่าวว่าผู้พบโปรตอนคือรัทเทอร์ฟอร์ด คลิ้กดูได้)
ทอมสันนำผลการทดลองของตนเองรวมกับผลการทดลองของโกลด์ชไตน์ แล้วเสนอแบบจำลองอะตอมขึ้นมาใหม่คือ
โดยจินตนาการว่า “ อะตอมมีลักษณะเป็นทรงกลม
ภายในประกอบด้วย โปรตอน , ( p )
และอิเล็กตรอน ( e- ) จำนวนเท่ากันกระจายอยู่ทั่วไปอย่างสม่ำเสมอ” อะตอมจึงเป็นกลางทางไฟฟ้า (neutral) เพราะประจุไฟฟ้าหักล้างกันหมดไป
แบบจำลองอะตอมของทอมสันนี้ บางครั้งจะเรียกว่า Thomson Plum Pudding model คำว่า pudding เป็นชื่อขนมชนิดหนึ่งของฝรั่ง แบบดั้งเดิมจะมี
เนื้อนุ่มคล้าย ๆ เต้าหู้นมสดของเรา แต่ ดัดแปลงทำด้วยขนมปังก็มี
ถ้ามีการใส่ลูกเกดหรือลูกพลัมลงไปด้วยก็เรียกว่า Plum Pudding ให้จินตนาการว่าแบบจำลองอะตอมของทอมสันมีลักษณะคล้าย
ๆ กับขนมชนิดนี้ ดังรูป

(คลิ้ก ดูรูปขนมพุดดิ้ง) (คลิ้ก ดูวิธีทำขนมพุดดิ้ง)
ความแตกต่างระหว่างรังสีรังสีแคโทดกับรังสีบวก
แม้ว่ารังสีทั้ง 2
ชนิดดังกล่างนี้จะเกิดขึ้นในหลอดรังสีแคโทดเช่นเดียวกัน แต่มีความแตกต่างกันดังต่อไปนี้
1. รังสีแคโทดเกิดจากอิเล็กตรอนวิ่งออกมาจากแคโทดไปยังแอโนด จึงเรียกว่ารังสีแคโทด ถ้ากระทบกับฉากเรืองแสง ( ฉากที่ฉาบด้วย ซิงค์ซัลไฟด์ ,ZnS ) จะเกิดการเรืองแสงขึ้น
(รังสี แคโทดคือ อิเล็กตรอนจำนวนมากที่พุ่งออกมาจากแคโทด)
2.
รังสีบวก หรือรังสีแคแนล
ไม่ได้พุ่งออกมาจากแอโนดโดยตรง
แต่เกิดจากรังสีแคโทด (อิเล็กตรอน) วิ่งไปชนกับอะตอมของแก๊สที่บรรจุอยู่ในหลอดรังสีแคโทด ทำให้อะตอมของแก๊สเสีย อิเล็กตรอน
กลายเป็นไอออนบวก จึงวิ่งย้อนกลับมาที่แคโทด แต่มีบางส่วนผ่านทะลุรูที่เจาะไว้ไปกระทบฉากเรืองแสง จึงเกิดการเรืองแสงขึ้น
(รังสีบวกเป็นไอออนบวกของแก๊สที่บรรจุอยู่ในหลอด รังสีแคโทด)
สมบัติของอิเล็กตรอนและโปรตอน
- ประจุไฟฟ้าของอิเล็กตรอนมีค่า =
-1.6 x 10-19 คูลอมม์
มวลของอิเล็กตรอน = 9.1 x 10-28 กรัม
= 9.1 x 10-31 กิโลกรัม
2.
ประจุไฟฟ้าของโปรตอนมีค่า = +1.6 x 10-19 คูลอมบ์
มวลของโปรตอน = 1.672
x 10-24 กรัม
หรือ = 1.67 x 10-24 กรัม
หรือ = 1.67 x 10-27 กิโลกรัม
ตัวอย่าง
ถ้ามีอิเล็กตรอนจำนวนหนึ่ง มีประจุไฟฟ้ารวมกันเท่ากับ -4.8 x 10 21 คูลอมบ์ อยากทราบว่าจะมีอิเล็กตรอนทั้งหมดกี่ตัว
วิธีทำ
ถ้ามีประจุไฟฟ้าของอิเล็กตรอน -1.6 x 10-19 คูลอมบ์
จะมีอิเล็กตรอน
1 ตัว
ฉะนั้นถ้ามีประจุไฟฟ้าของอิเล็กตรอน - 4.8 x 10 21 คูลอมบ์ จะมีอิเล็กตรอน (-4.8 x 1021 คูลอมบ์) / (-1.6 x 10-19 คูลอมบ์)
= 3.0 x 1040 ตัว ตอบ
อะตอมในภาวะปกติกับไอออน
อะตอมในภาวะปกติมีจำนวนอิเล็กตรอนเท่ากับโปรตอน จึงเป็นกลาง (neutral) ทางไฟฟ้า เพราะประจุไฟฟ้าหักล้างกันหมดไป แต่อิเล็กตรอนเป็นอนุภาคที่มีมวลน้อยและเคลื่อนที่อยู่ ตลอดเวลา จึงสามารถเคลื่อนที่ออกจากอะตอมหนึ่งไปอยู่กับอะตอมอื่นได้ ทำให้อะตอมมีจำนวนโปรตอนกับจำนวนอิเล็กตรอนไม่เท่ากัน อะตอมจึงไม่เป็นกลางอีกต่อไป กลายเป็นอนุภาคที่มี ประจุไฟฟ้า
เรียกว่าไอออน (ion) มี
2 แบบ คือ อะตอมที่เสียอิเล็กตรอน จะมีจำนวนโปรตอนมากกว่าจำนวนอิเล็กตรอน ทำให้มีประจุไฟฟ้าเป็นบวก เรียกว่าไอออนบวก (Cation
อ่านว่า แคท- ไอออน)
ให้สังเกตว่าขนาดของไอออนบวกจะเล็กกว่าขนาดของอะตอมในภาวะปกติ ดังรูป
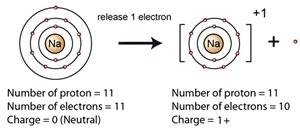
สำหรับอะตอมที่ได้รับอิเล็กตรอน จะมีจำนวนอิเล็กตรอนมากกว่าจำนวนโปรตอน ทำให้มีประจุไฟฟ้าเป็นลบ เรียกว่าไอออนลบ (anion อ่านว่า แอน-ไอออน )
ให้สังเกตว่า ขนาดของ ไอออนลบจะใหญ่กว่าขนาดของอะตอมในภาวะปกติ ดังรูป

แบบฝึกหัด
1. เราทราบค่ามวลของอิเล็กตรอนได้จากการทดลองของใคร
(ตอบ. 4)
1.
Thomson 2. Millikan 3. Rutherford 4. Thomson และ Millikan
2. ความแตกต่างระหว่างแบบจำลองอะตอมของทอมสันและรัทเทอร์ฟอร์ดคือข้อใด(ตอบ.
2)
1.
ชนิดของอนุภาคที่อยู่ในอะตอม 2. ตำแหน่งของอนุภาคที่อยู่ในอะตอม
3.
จำนวนอนุภาคที่อยู่ในอะตอม 4.
ขนาดของอนุภาคที่อยู่ในอะตอม
3. ผลการทดลองของรัทเทอร์ฟอร์ดในข้อใดที่ไม่สอดคล้องกับแบบจำลองอะตอมของทอมสัน(ตอบ.
3)
1.
อนุภาคอัลฟาผ่านทะลุแผ่นทองคำมีลักษณะเป็นเส้นตรง
2.
อนุภาคอัลฟาผ่านทะลุแผ่นทองคำไปได้มีแต่การเบี่ยงเบน
3.
อนุภาคอัลฟาวิ่งชนแผ่นทองคำแล้วสะท้อนกลับ
4.
อนุภาคอัลฟาบางอนุภาคถูกดูดกลืน
4. จากการทดลองของโกลด์สไตน์ทำให้สรุปได้ว่า (ตอบ. 4)
1.
รังสีบวกมีจำนวนประจุเท่ากันเสมอไม่ว่าจะใช้แก๊สใด
2.
รังสีบวกมีมวลเท่ากันเสมอไม่ว่าจะใช้แก๊สใด
3.
รังสีบวกไม่มีทั้งประจุและมวล
4.
รังสีบวกของแก๊สแต่ละชนิดมีสมบัติบางประการต่างกัน
5. การทดลองในข้อทำให้ทราบค่า e/m
ของอิเล็กตรอน (ตอบ. 2)
1.
การทดลองโดยวิธีเม็ดน้ำมันของมิลลิแกน
2.
การทดลองโดยให้รังสีแคโทดอยู่ในสนามไฟฟ้าของทอมสัน
3.
การทดลองโดยให้รังสีแคโทดอยู่ในสนามไฟฟ้าและสนามแม่เหล็กของทอมสัน
4.
การทดลองเรื่องอิเล็กโทรลิซิสของฟราเดย์
6. อนุภาคประจุบวกหรือรังสีบวกที่โกลด์สไตน์พบว่ามีอยู่ในหลอดรังสีแคโทดคือสิ่งใด
(ตอบ. 4)
1. โปรตอน 2. นิวตรอน 3. อิเล็กตรอน 4. ไอออนบวก
7. ค่า e/m ของไอออนบวกชนิดใดมีค่ามากที่สุด (กำหนดมวลของ Li=7 Na=23
K=39 Ca=40) (ตอบ.
1)
1.
Li 2. Na 3. K 4. Ca
8. จงพิจารณาข้อความต่อไปนี้ข้อใดถูกต้อง (ตอบ. 4)
ก. จอห์นดอลตันเสนอว่าอะตอมเป็นรูปทรงกรวย
ประกอบอนุภาคที่มีประจุบวกและประจุลบจำนวน
เท่ากันและ กระจายอยู่ทั่วไป
ข. เจ.เจ. ทอมสันได้ทดลองและสรุปได้ว่าอะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบและ
หาอัตราส่วนของประจุต่อมวลของอนุภาคได้ค่าคงที่
ค. โกลด์สไตน์
พบอนุภาคมีประจุบวก และอัตราส่วนของประจุต่อมวลคงที่
ง. มิลลิแกนทำการทดลองหาค่าประจุของอิเล็กตรอนและสามารถคำนวณหามวลของอิเล็กตรอนได้
จ. รัทเทอร์ฟอร์ดได้เสนอว่าอะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลางมีขนาดเล็ก
แต่มีมวลมากและมีประจุบวก
ส่วนอิเล็กตรอนมีมวลน้อย และมีประจุลบวิ่งรอบนิวเคลียส
ฉ. เจมส์แชดวิกได้ทำการทดลองและสรุปได้ว่าในนิวเคลียสของอะตอมมีอนุภาคที่เป็นกลางทาง
ไฟฟ้าอยู่ด้วยเรียกว่านิวตรอน
1. ก ข ค ง 2. ค ง จ ฉ 3.
ก ค จ ฉ 4.
ข ง จ ฉ
9. (เคมีโอลิมปิค 45) ทฤษฎีอะตอมของดอลตันในข้อใดต่อไปนี้ที่ยังคงใช้ได้ในปัจจุบัน (ตอบ. 4)
ก.
สารประกอบด้วยอนุภาคขนาดเล็กเรียกว่าอะตอม
ข.
อะตอมจะแบ่งแยกไม่ได้ สร้างขึ้นหรือสูญหายไม่ได้
ค.
อะตอมของธาตุชนิดเดียวกันจะมีมวลเท่ากัน มีสมบัติเหมือนกัน แต่จะแตกต่างจากอะตอมของธาตุอื่น
ง.
สารประกอบเกิดจากการรวมตัวของอะตอมของธาตุ
มีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย
1. ก ข 2. ก ข
ค ง 3. ก ค ง 4.
ก ง
10. (เคมีโอลิมปิค .47) ผลที่ได้จากการศึกษาการนำไฟฟ้าของแก๊ส โดยการผ่านไฟฟ้ากระแสตรงเข้าไปใน
หลอดแก้วบรรจุแก๊สความดันต่ำ เกือบเป็นสุญญากาศดังรูป สามารถเป็นหลักฐานของข้อสรุปใด
(ตอบ. 2)
1. อิเล็กตรอนโคจรรอบนิวเคลียสที่ระดับพลังงานต่าง
ๆ
2. ในอะตอมมีอนุภาคประจุลบรวมอยู่ด้วย
3. ในอะตอมมีอนุภาคประจุบวกรวมอยู่ด้วย
4. อะตอมประกอบไปด้วยอนุภาคประจุลบและอนุภาคประจุบวก
11. (เคมีโอลิมปิค 47) ถ้าอะตอมมีลักษณะดังที่ทอมสันเสนอ คือมีโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไป
ในอะตอม
การทดลองของรัทเทอร์ฟอร์ดที่ยิงอนุภาคอัลฟาไปยังแผ่นทองคำบาง ๆ
โดยมีฉากเรืองแสง
โค้งเป็นวงล้อมรอบอยู่ จะเห็นผลอย่างไร (ตอบ. 2)
1. เห็นการเรืองแสงด้านข้างเป็นส่วนใหญ่
และมีด้านหลังบ้าง
2. เห็นการเรืองแสงด้านหลังเป็นส่วนใหญ่ และมีด้านข้างบ้าง
3. เห็นการเรืองแสงด้านหน้าเป็นส่วนใหญ่ และมีด้านข้างบ้าง
4.
แทบไม่เห็นการเรืองแสงเพราะอนุภาคอัลฟาถูกจับไว้หมด
12.
(เคมีโอลิมปิค 47) จากข้อ 11
ถ้าเปลี่ยนจากแผ่นทองคำเป็นแผ่นตะกั่ว
ซึ่งไม่สามารถทำให้บางขนาดแผ่นทองคำได้จะเห็นผลการทดลองอย่างไร (ตอบ. 1)
1.
เห็นการเรืองแสงด้านข้างเป็นส่วนใหญ่เนื่องจากความหนาแน่นของตะกั่ว
2. เห็นการเรืองแสงด้านหลังเป็นส่วนใหญ่
เนื่องจากความหนาไม่มีผลอะไร
3. เห็นการเรืองแสงด้านหน้าเป็นส่วนใหญ่ เนื่องจากเกิดการสะท้อนมาก
4.
แทบไม่เห็นการเรืองแสงเลย
เนื่องจากเกิดการสะท้อนมาก
13. ค่าประจุ/มวล ของอิเล็กตรอน หรือ e/m ที่ทอมสันคำนวณได้มีค่าเท่าไร (ตอบ. 1)
1.
-1.76 x 108
คูลอมบ์/กรัม 2. -9.1 x 10-28 คูลอมบ์/กรัม
3. -1.6 x 10-19 คูลอมบ์/กรัม 4.
-1.66 x 10-24 คูลอมบ์/กรัม
14. จากการทดลองของมิลลิแกนทำให้ทราบว่าอิเล็กตรอนมีประจุเท่าไร
(ตอบ. 1)
1. -1.6 x 10-19 คูลอมบ์ 2. +1.6 x
10-19
คูลอมบ์
3. 1.76 x 108 คูลอมบ์ 4. 9.1 x 10-28 คูลอมบ์
15. ข้อใดเป็นคำกล่าวที่ถูกต้องเกี่ยวกับอะตอมและไอออนบวกของธาตุชนิดเดียวกัน (ตอบ. 1)
1. ไอออนบวกมีจำนวนอิเล็กตรอนน้อยกว่าเลขเชิงอะตอม
2. ไอออนบวกมีจำนวนโปรตอนน้อยกว่าเลขเชิงอะตอม
3. ไอออนบวกมีจำนวนโปรตอนเท่ากับเลขเชิงอะตอม
4. ไอออนบวกมีจำนวนโปรตอนมากกว่าเลขเชิงอะตอม
16. ข้อใดหมายถึงนิวคลีออน (
Nucleon ) (ตอบ. 4)
1. อิเล็กตรอน+โปรตอน 2.
นิวตรอน+อิเล็กตรอน
3. นิวเคลียส+อิเล็กตรอน 4. นิวตรอน+โปรตอน
17.
Below
write out equations showing whether an element gains or loses electron. Indicate if the
final
ion is a cation or anion.
(สมการต่อไปนี้แสดงถึงการที่อะตอมได้รับหรือเสียอิเล็กตรอน ตามจำนวนที่กำหนด จงบอกชนิดของ
ไอออนที่เกิดขึ้น)
|
equations showing whether an element
gains or loses electron
|
Type of Ion
|
|
K loses 1e- →
K+
|
Cation
|
|
O gains 2e- →
O2-
|
Anion
|
|
Mg loses 2e- →
|
|
|
Al loses 3e- →
|
|
|
F gains 1e- →
|
|
|
S gains 2e- →
|
|
|
Na loses 1e- →
|
|
|
N gains 3e- →
|
|
|
Ba loses 2e- →
|
|
|
Br gains 1e- →
|
|
|
I gains 1e- →
|
|
|
Ra loses 2e- →
|
|
|
Ca loses 2e- →
|
|
|
Cl gains 1e- →
|
|
|
Sr loses 2e- →
|
|
|
P gains 3e- →
|
|
18. Which subatomic particles carry a
negative charge?
(อนุภาคชนิดใดของอะตอมมีประจุไฟฟ้าเป็นลบ)
______________________
19. Match each term from the experiments of J. J. Thomson with the
correct description.
(จงจับคู่ระหว่างข้อความทางซ้ายกับทางขวา)
_______ 20.1 Anode a. an
electrode with a
negative charge
(แอโนด) (ขั้วไฟฟ้าที่ต่อกับขั้วลบ)
_______ 20.2 cathode
b. a
glowing beam traveling between charged
(แคโทด)
electrodes
(มีแนวในการเคลื่อนที่อยู่ระหว่างขั้วไฟฟ้าทั้งสอง)
_______ 20.3 cathode
ray c. an
electrode with a positive charge
(รังสีแคโทด) (ขั้วไฟฟ้าที่ต่อกับขั้วบวก)
_______ 20.4 Electron
d. a negatively charged
particle
(อิเล็กตรอน)
(อนุภาคที่มีประจุลบ)
20. Thomson observed
that the production of cathode rays did not depend on the kind
of gas in
the tube or the type of metal
used for the electrodes. What conclusion did he draw from
these
observations?
(เมื่อทอมสันพบว่ารังสีแคโทดไม่ขึ้นอยู่กับชนิดของแก๊สที่บรรจุในหลอดรังสีแคโทด และไม่ขึ้นอยู่กับชนิด
ของโลหะที่ใช้ทำขั้วไฟฟ้า ทำให้เขาได้ข้อสรุปว่าอย่างไร)
21. Circle the
letter of each sentence that is true about atoms, matter, and electric charge.
(จงวงรอบตัวอัษรหน้าข้อความที่ถูกต้อง เกี่ยวกับอะตอม สาร
และประจุไฟฟ้า)
a. All atoms have an electric charge. (อะตอมทั้งหลายมีประจุไฟฟ้า)
b. Electric charges are
carried by particles of matter.
(ประจุไฟฟ้าจะอยู่ที่อนุภาคของสารต่าง ๆ)
c. Electric charges always
exist in whole-number multiples of a single basic unit.
(ประจุไฟฟ้าจะมี
อยู่ที่อนุภาคมูลฐานทั้งหมดของอะตอม)
d. When a given number of
positively charged particles combines with an equal
number of
negatively charged
particles, an electrically neutral particle is formed. (ถ้ามีอนุภาคประจุบวก
เท่ากับอนุภาคประจุลบ จะทำให้อนุภาคเป็นกลาง)
22. Circle the letter next to the number of
units of positive charge that remain if a hydrogen atom
loses
an electron. (เมื่ออะตอมของไฮโดรเจนเสียอิเล็กตรอน 1 ตัว ประจุไฟฟ้าบวกที่เกิดขึ้นจะเป็นเท่าไร)
a.
0 b.
1 c.
2 d.
3
23. The positively charged subatomic
particle that remains when a hydrogen atom loses an
electron is called (เมื่ออะตอมของไฮโดรเจนเสียอิเล็กตรอนไป 1
ตัว สิ่งที่เหลือจะเรียกว่าอะไร) ______________________
.
24. What did J.J. Thompson discover? (J.J. Thompson เป็นผู้ค้นพบสิ่งใด)
.........................................................................................................................................................
25. What is the charge of an electron? (อิเล็กตรอนมีประจุไฟฟ้าชนิดใด)
.........................................................................................................................................................
26. What are cathode rays made of ? (รังสีแคโทดเกิดจากอะไร)
...........................................................
27. Why do electrons move from
the negative end of the tube to the positive end?
(เพราะเหตุใดอิเล็กตรอนจึงเคลื่อนที่จากปลายหลอดด้านลบไปยังปลายหลอดด้านบวก)
.....................................................................................................................................................
28. What
was Thompson working with when he discovered the cathode rays?
(เมื่อทอมสันพบรังสีแคโทดแล้ว ได้ทำการทดลองอย่างไรกับรังสีแคโทดบ้าง)
...................................................................................................................................................
Content's Picture

Size : 24.78 KBs
Upload : 2014-03-15 14:21:38
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|









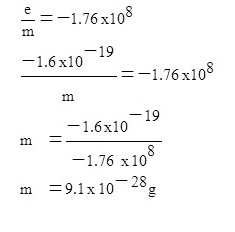






 Vote(s)
Vote(s)

